
검색

면역항암제없는 틈새 공략...이뮨온시아 "효과·안전 확인"
기사입력 : 22.12.06 06:00:32
0
가
 플친추가
플친추가
 플친추가
플친추가
[ESMO Asia 2022] 이뮨온시아, IMC-001 2상 중간결과 구두 발표
재발 시 생존 6개월 불과한 희귀 림프종, IMC-001 투여로 1년 이상 치료
10명 중 6명 반응, 반응 시 모두 완전관해…"빠른 상용화 추진"


▲김흥태 이뮨온시아 대표
김흥태 이뮨온시아 대표는 3일(현지시간) 싱가포르에서 열린 '2022 유럽종양학회 아시아 학술대회(ESMO Asia 2022)'에서 이 같은 포부를 밝혔다.
이뮨온시아는 유한양행과 미국 바이오기업 소렌토 테라퓨틱스가 합작해 설립한 면역항암제 전문 신약 개발 기업이다. PD-L1 항체 IMC-001을 비롯해 CD47 항체 IMC-002 등 여러 파이프라인을 보유하고 있다. 국립암센터 종양내과 교수로서 폐암과 식도암 분야 권위자로 손꼽혔던 김 대표가 33년간 몸담았던 학계를 떠나 선택한 바이오벤처로 주목을 받았다.
올해 ESMO Asia는 김 대표에게도 의미가 남다르다. 지난 2021년 7월 이뮨온시아 대표로 선임된 후 글로벌 학회에서 자사 임상 결과를 선보이는 첫 자리다. 국내 임상이고 모집단이 10명 남짓함에도 구두 발표 세션에 선정됐다. 이번 연구는 표준치료요법인 'L-아스파라기나제(L-asparaginase)'로 효과를 보지 못한 재발성·불응성 NK·T세포 림프종 환자 13명을 대상으로 한 국내 2상 임상 중간 분석 결과다. 혈액암 권위자로 꼽히는 김원석 삼성서울병원 혈액종양내과 교수가 '미니 오럴-혈액암' 세션에서 발표를 진행했다.


▲IMC-001 2상 유효성 중간분석 결과(자료: ESMO Asia)
임상 중간 분석 결과, 평가 가능한 10명 환자 중 6명이 반응(ORR=60%)했고, 반응을 보인 환자 모두 완전관해(CR=100%)를 보였다. 이 중 4명은 1년 이상 투여를 지속해 약물 안전성과 반응 지속성 측면에서 우수한 성과를 냈다는 평가다.
안전성에서도 합격점을 받았다. 면역항암제가 주로 보이는 사이토카인 신드롬이나 혈액학적 독성 부작용이 발견되지 않았다. 1명에서만 3등급 수준의 포도막염이 관찰됐다. 임상 중 3명이 부작용으로 인해 투약 기간을 조정했으며, 1명이 코로나19 감염으로 투약이 지연됐다. 주요 이상반응은 피로, 두통, 피부발진, 가려움 등이었으며 대부분 경증으로 관리 가능한 수준이었다.

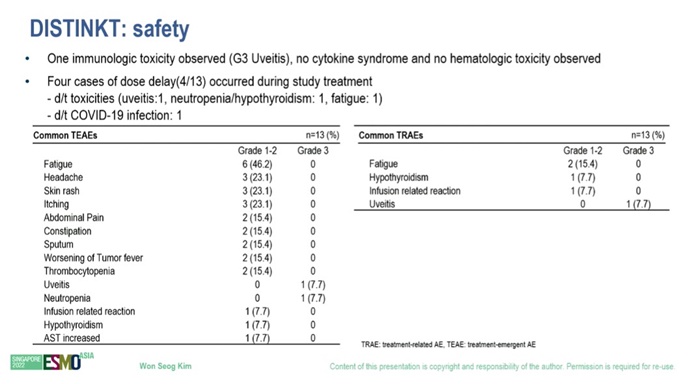
▲IMC-001 2상 안전성 중간분석 결과(자료: ESMO Asia)
김 교수는 "분석 환자 수가 적어 IMC-001가 월등히 우월한 치료제라 단정지을 수 없다"면서도 "적어도 (기존 면역항암제와 비교해) 비슷하거나 조금 더 우월하다고 본다. 재발성 환자의 경우 생존기간이 4~6개월 정도밖에 되지 않는데, IMC-001에 반응한 6명 중 4명은 치료 기간이 1년을 넘는 등 상당히 장기간 생존하고 있다"고 평가했다.
IMC-001은 PD-L1 기전의 면역항암제다. 동일 기전의 항암제로는 글로벌 판매 21조원에 달하는 키트루다(성분명 펨브롤리주맙)와 10조원을 올린 옵디보(성분명 니볼루맙)가 있다. IMC-001이 임상을 진행 중인 NK·T세포 림프종은 키트루다와 옵디보가 적응증을 갖고 있지 않다. 서양에서는 비교적 드문 질환이다 보니 관심에서 벗어난 것이다. 하지만 아시아에서는 비교적 흔히 발병되는 급성 림프종 중 하나로 시장이 작지 않다. 한 마디로 틈새 시장이다.


▲김원석 삼성서울병원 교수
희귀암인 NK·T세포 림프종은 엡스타인바 바이러스(EBV) 감염과 관련 있는데 동양인의 약 90%가 이 바이러스에 감염돼 있다. 일반인은 감염되더라도 문제가 없지만 면역체계가 손상돼 있으면 잠복하던 바이러스가 활성화하며 암을 유발한다. 현재 치료법은 방사선과 항암화학요법이 주를 이루는데, 2년 이내 재발률이 75%에 달한다.
김 교수는 "우리나라를 포함한 남중국, 일본 등 아시아 지역에서는 가장 흔히 보이는 T세포 림프종이 바로 NK·T세포 림프종이다. 그런 면에서 시장이 작지 않은데 서양에서 관심도가 떨어지다 보니 한 번도 허가 임상이 체계적으로 이뤄진 적이 없다"며 "IMC-001으로 진행 중인 허가 임상이 상당히 빠른 편에 속한다"고 설명했다.
이뮨온시아는 내년 2분기쯤 임상이 완료되고 최종 데이터를 얻으면 곧바로 허가 절차에 착수할 계획이다. 글로벌 진출을 위한 IMC-001의 기술수출도 적극적으로 추진한다.
내년에는 코스닥 상장에도 속도를 높인다. 이뮨온시아는 지난 7월 기술성 평가에서 고배를 마셔 기술특례상장 일정이 지연된 바 있다. 내년 하반기 내 기술성 평가를 다시 받겠다는 계획이다.
김 대표는 "국내 빠른 상용화로 틈새 시장을 선점한 후 차차 적응증을 늘리고자 한다. 환자가 많은 중국 등 아시아 지역은 기술수출을 추진할 계획이다. 기술성 평가는 내년 3분기쯤 재신청할 예정"이라고 전했다.
정새임 기자(same@dailypharm.com)
글자크기 설정
가나다라마바사
가나다라마바사
가나다라마바사
관련기사


0/300
이용약관 | 개인정보 취급방침 | 법적고지
Copyright ⓒ Dailypharm 1999-2025,All rights reserved.
메일보내기
기사제목 : 면역항암제없는 틈새 공략...이뮨온시아 효과·안전 확인

















