
검색

채용
정보
정보
삼바에피스, ADC에 3번째 투자...신약 상용화 정조준
기사입력 : 24.03.26 12:05:01
0
가
 플친추가
플친추가
 플친추가
플친추가
미국 브릭바이오에 지분 투자나서…에임드바이오·아라리스바이오에 이어 세번째
ADC 링커 기술력 확보 분주…CDMO 생산 능력 갖추는 동시에 신약 상용화 초점
- PR
- 제조품질관리 역량강화 세미나 신청
- 2025.11.21(금)
26일 관련 업계에 따르면 삼성그룹은 최근 라이프 사이언스 펀드를 통해 ADC 전문 개발 기업인 브릭바이오에 투자한다고 밝혔다. 라이프 사이언스 펀드는 삼성바이오에피스와 삼성물산, 삼성바이오로직스가 공동으로 1700억원을 출자해 조성한 바이오벤처 투자 펀드다.
삼성그룹은 스위스 아라리스바이오, 국내기업 에임드바이오에 이어 3번째로 ADC 개발 기업에 투자하게 됐다.
삼성바이오로직스는 오는 12월 ADC 전용 생산 시설을 준공을 예정하고 있다. 삼성그룹은 ADC CDMO 위탁개발 생산 능력을 갖추는 동시에 지분 투자를 통해 자체 신약을 확보하겠다는 목표다.

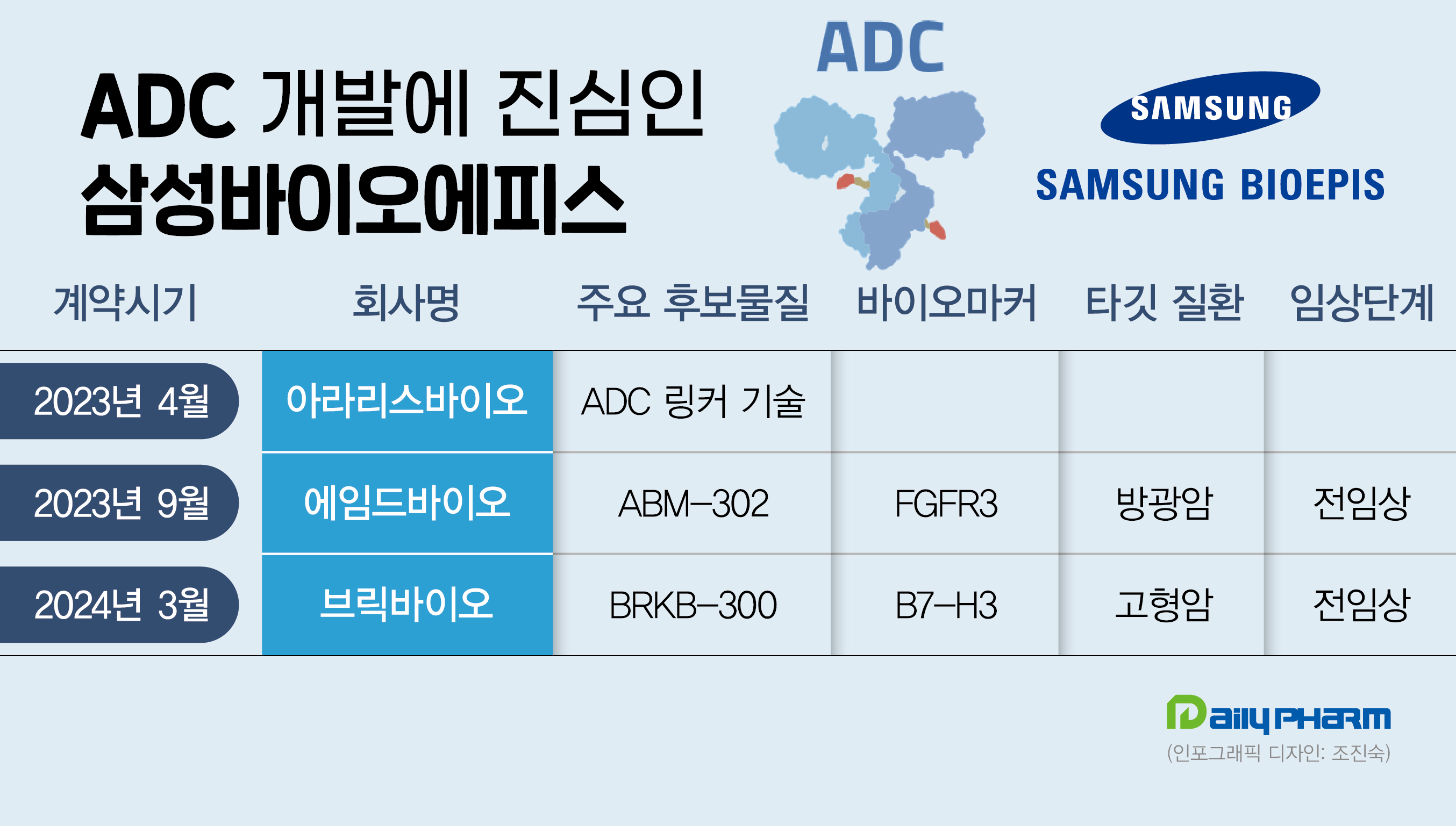
이번에 삼성그룹이 투자를 진행한 미국 기업 브릭바이오는 Evolved tRNA Localization(ETRNAL) 플랫폼을 보유하고 있다. 이 플랫폼을 통해 브릭바이오는 변형 tRNA(운반RNA)를 활용해 인공 아미노산을 단백질의 특정 위치에 결합시킬 수 있다. 특히 브릭바이오가 보유하고 있는 링커는 혈액과 같은 수성 용액에 용해되므로 항체/페이로드 구조를 추가적인 편집 없이 암세포에 적절하게 결합할 수 있다는 장점을 갖고 있다.
현재 브릭바이오가 개발 중인 후보물질은 BRKB-300, BRKB-400, BRKB-20, BRKB-500 등이다. BRKB-300은 B7-H3을 타깃해 고형암 ADC를 개발하고 있으며 현재 임상시험계획(IND) 승인을 준비 중이다. 해당 기전으로 상용화된 제품은 아직 없는 상황이다. BRKB-400 등 나머지 신약후보물질은 전임상 또는 후보물질 탐색을 진행 중이다.
에임드바이오는 방광암에서 주로 발현되는 바이오머커인 FGFR3를 타깃하는 ADC 후보물질 ABM302를 보유하고 있다. ABM302는 중국 진퀸텀 헬스케어와 공동개발하고 있으며 에임드바이오가 개발한 FGFR3 항체에 진퀌텀의 링커-페이로드 기술이 접목됐다.
에임드바이오의 ADC 기술은 항체와 페이로드의 비율(DAR)을 조절할 수 있는 것이 특징이다. FGFR3은 고형암 치료를 위한 주요 단백질이지만 해당 기전 ADC로 개발된 의약품은 아직까지 없다.
전임상에서 ABM302는 원숭이 대상 투여에서 내약성과 안전성을 확인한 바 있다.
X

AD

NEW POSM 신청
이벤트참여 →
삼성바이오에피스는 스위스 기업 아라리스바이오텍과도 ADC 연구 개발에 나선다. 아라리스는 단일 공정만으로 항체와 결합이 가능한 링커 기술을 보유하고 있다.
아라리스의 링커 기술은 IgG-Fc 내 특정 아미노산(Q295)의 부위별 페이로드 부착을 가능하게 한다. 페이로드가 이 부위에 부착되면 항체는 거의 동일한 약동학적 성능을 유지한다. 또 링커 페이로드는 펩타이드 결합을 통해 항체에 연결돼 혈류에서 탁월한 안정성을 유지해 건강한 조직 손상을 피할 수 있다. 이 세 가지 특성은 모두 가장 효율적인 페이로드 전달과 최대 ADC 효율을 가능하게 하는 핵심 요소로 분류된다.
ADC 기술 확보 분주…새로운 3세대 ADC 등장 필요성 대두
ADC는 암세포 표면의 특정 표적 항원에 결합하는 항체와 세포사멸 기능을 갖는 약물을 링커로 연결해 만든 항암 신약이다. ADC는 항체의 표적에 대한 선택성과 약물의 사멸 활성을 이용해 약물이 암세포에만 선택적으로 작용하게 함으로써 치료효과는 높이고 부작용은 최소화할 수 있다는 장점이 있다.
ADC 신약을 개발하기 위해선 타깃 설정뿐만 아니라 링커 기술 확보가 필수적이다. 약물과 항체의 연결이 잘 이뤄지지 않으면 약물이 암세포에 도달하기 전에 항체에서 분리될 수 있다. 삼성그룹이 투자한 기업들은 항체 신약, 고유 링커 기술 확보에 성공했다는 평가다.
1세대 ADC인 로슈 캐싸일라가 유방암 적응증 확보에 그친 반면 2세대 ADC들은 다양한 적응증 확보에 성공하고 있다. 엔허투는 유방암, 위암, 비소세포폐암, 대장암 등 다양한 고형암 영역에서 효과를 나타내고 있다. 유방암 적응증을 확보한 길리어드의 트로델비 역시 비소세포폐암, 요로상피암 등에서도 효과를 나타내고 있다. 여러 적응증 확보 길이 열린 만큼 국내외서 후속 ADC 개발에 열을 올리고 있다.
현재 시판되거나 개발 중인 많은 항체약물접합체는 면역글로불린(IgG) 항체에 미세소관억제제(microtubule inhibitor) 혹은 DNA 손상 제제를 페이로드로 수소이온지수(pH) 의존적 혹은 절제 불가능한 링커에 결합해 사용하고 있다.
pH 의존적인 링커는 혈장 순환 중 불완전해 전신 독성의 우려가 있는 반면, 소수성이 강한 링커는 높은 응집력과 연관돼 저조한 체내 동태 및 효능을 보인다.
이에 따라 새로운 기전의 약물, 높고 균일한 약물-항체 비율, 절단 가능하면서도 혈장 내 안정적인 링커와 표적 단백질의 발현이 낮은 이질적인 종양 세포 환경에서도 효과를 보일 수 있는 새로운 ADC의 필요성이 대두되는 상황이다.
손형민 기자(shm@dailypharm.com)
글자크기 설정
가나다라마바사
가나다라마바사
가나다라마바사
관련기사


0/300
이용약관 | 개인정보 취급방침 | 법적고지
Copyright ⓒ Dailypharm 1999-2025,All rights reserved.
메일보내기
기사제목 : 삼바에피스, ADC에 3번째 투자...신약 상용화 정조준

















