- LOGIN
- MemberShip
- 2025-12-20 08:35:10
- Reassessing the plan for comparing foreign drug prices
- by Lee, Tak-Sun | translator Kang, Shin-Kook | 2024-07-12 05:48:01
The government will likely reassess foreign drug price comparison by evaluating the therapeutic category with the highest number of products.
Consequently, gastrointestinal agents, high blood pressure drugs, and antibiotics will be assessed in the first year.
There are over 2000 products in these three therapeutic categories.
Furthermore, drugs with the same ingredient products produced by fewer than three companies will likely to be excluded from the assessment.
According to industry sources on July 10th, the government is gathering opinions from pharmaceutical companies about the current reassessment plan, which has been shared through ten meetings with the pharmaceutical industry (as of July 5th).
The current reassessment plan is not the final one.
The issue is still ongoing because it does not include the referencing sources of Germany and Canada.
In the first year, according to the reassessment plan, therapeutic categories with the highest number of products, including gastrointestinal agents (2043 products), high blood pressure drugs (2268 products), and antibiotics (2156 products), will be assessed.
In the second year, hyperlipidemia drugs, respiratory system medications, central nervous system medications, diabetes drugs, and musculoskeletal disorder medications will be assessed.
In the third year, ophthalmology drugs, otolaryngology drugs, dentistry drugs, painkillers, urological and reproductive system medications, anticoagulants, dermatological treatments, anticancer agents, and 17 other therapeutic categories will be assessed.
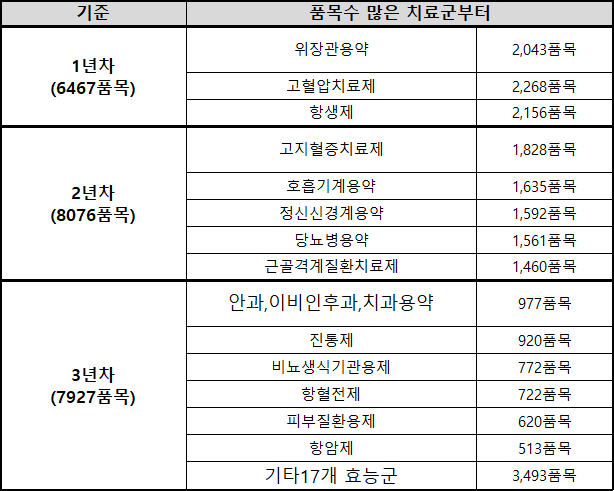
(Therapeutic category with the highest number of products) In the first year, gastrointestinal agents (2043 products), high blood pressure drugs (2268 products), and antibiotics (2156 products), will be assessed.
In the second year, hyperlipidemia drugs, respiratory system medications, central nervous system medications, diabetes drugs, and musculoskeletal disorder medications will be assessed.
In the third year, ophthalmology drugs, otolaryngology drugs, dentistry drugs, painkillers, urological and reproductive system medications, anticoagulants, dermatological treatments, anticancer agents, and 17 other therapeutic categories will be assessed. However, exclusion will be applied to ▲low-priced drugs, orphan drugs, drugs that have been listed as shortage prevention drugs (SPD) ▲Oxygen, nitrogen dioxide, saline solutions, artificial perfusion agents, and radioactive drugs ▲Narcotics ▲Drugs with the same administration, ingredients, and formulation produced by fewer than three companies ▲Products undergone price increases (after January 2020).
During the discussion, drugs with the same administration, ingredients, and formulation produced by fewer than three companies were added to the list.
A reference price for adjustment is the average price of drugs found in A8 countries.
Adjusted mean price will exclude the highest and the lowest prices.
Products with a higher drug price than the calculated reference amount will be subjected to a reduction.
In cases where fewer than 2 out of 8 countries can be found, the average reduction rate of the most similar product is applied, considering factors such as content, ingredients, formulations, and administration methods.
Products with generic prices higher than the standard amount calculated using the highest price within the same product will be reduced.
When calculating the average reduction rate, if a negative reduction rate occurs due to lower prices compared to foreign countries, it will be reflected as such in the calculation.
For combination therapies, if the assessed amount is lower than the sum of the assessed amounts for monotherapy or combination therapy, the reduction will be limited to the sum of the amounts assessed.
The prices of pharmaceuticals that have submitted the required documents will be reduced to the amount assessed for their intended development products.
Furthermore, it has been revealed that the current plan included the addition of criteria stating that the calculation of price adjustments referencing foreign drug prices should be based on public prices reimbursed or reimbursed equivalently in the respective country.
The pharmaceutical industry's significant opposition to the public reimbursement requirements during the tenth meeting may prompt revisions in the final plan.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










