- LOGIN
- MemberShip
- 2025-12-23 07:24:23
- MFDS approves emergency use of Pfizer’s oral COVID-19 drug
- by Lee, Tak-Sun | translator Alice Kang | 2021-12-28 05:50:52

Authorities plan to use the drug to treat adults and pediatric patients over the age of 12 with mild-to-moderate COVID-19 at high risk of progressing to severe disease.
Pharmacies will be supplying the pills for patients treated from their homes.
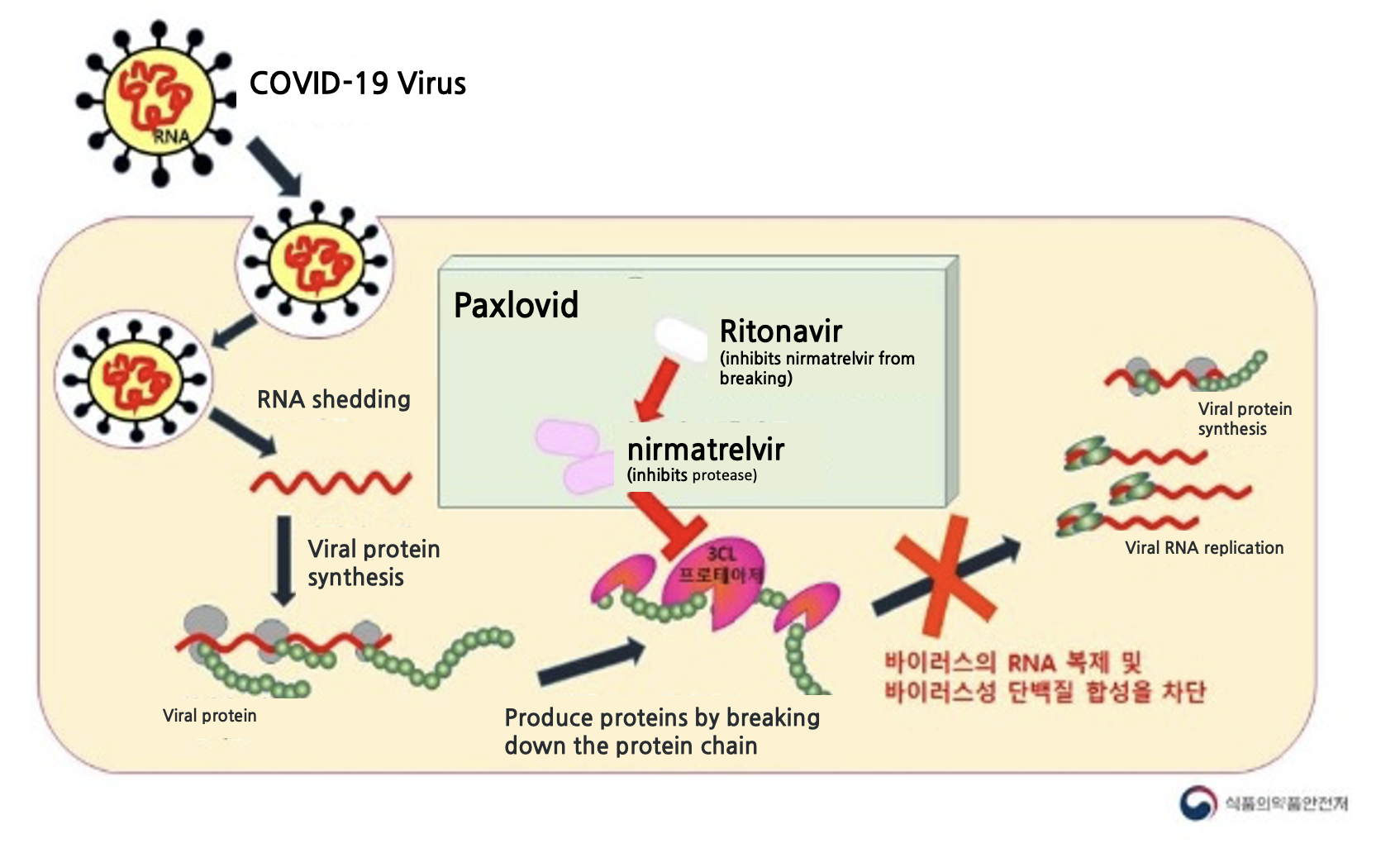
On the 27th, the Ministry of Food and Drug Safety announced that it had authorized the emergency use of ‘Paxlovid,’ an oral COVID-19 treatment developed by the US company Pfizer.
The decision was made after a comprehensive deliberation into the need to introduce oral treatment options that patients can self—administer amid the growing number of confirmed severe/critical COVID-19 cases and the MFDS’s safety/efficacy review results, as well as expert advisory meeting results at the ‘Public Health Crisis Response Medical Product Safety Management and Supply Committee.’ ‘Paxlovid’ is the first oral treatment to be introduced to Korea.
The government said that it plans to diversify treatment options that may be used by patients in addition to the shot-type treatment used in the field and expect the addition of Paxlovid to support the prevention of patients treated at residential treatment centers and home from progressing to severe diseases.
In a clinical trial that enrolled 2,246 non-hospitalized, mild-to-moderate COVID-19 patients at high risk of progressing to severe disease, the drug reduced COVID-19 hospitalization or death by 88% in patients who took the pill within 5 days of symptom onset.
In particular, the drug also showed the same effect in a clinical trial that enrolled around 300 Asians, including 19 Koreans.
The drug may be administered on adult patients and pediatric patients (12 and older weighing at least 40 kg) with mild-to-moderate COVID-19 that are at high risk of progressing to severe COVID-19 due to age, underlying disease, etc.
Paxlovid is administered as ‘three tablets (two tablets of nirmatrelvir and one tablet of ritonavir) taken together orally, twice daily for five days, and should be initiated as soon as possible after the diagnosis of COVID-19 and within five days of symptom onset.
The Korea Disease Control and Prevention Agency (KDCA) has requested a priority review of ‘Paxlovid’ on the 22nd to the MFDS due to the rising need to introduce oral COVID-19 treatments that patients can take on their own in the process of returning to normal.
The MFDS has been conducting a preliminary review on the quality, clinical, and nonclinical data of ‘Paxlovid’ from November 10th before the KDCA requested a review for the emergency use approval.
Also, the ministry had received advice from external experts (9 people) in various fields including infectious diseases, respiratory medicine, toxicology, and virology.
As a result, experts agreed on the need to grant emergency use approval for ‘Paxlovid’ in consideration of the COVID-19 pandemic situation and the nonclinical and clinical trial results, and the feasibility of the subject patient population as proposed by the MFDS.
The MFDS said it will continue its efforts after granting the emergency use approval to collect information on adverse events that may arise in the process of using ‘Paxlovid’ while preparing further safety measures.
In addition, the authorities will request the company that imports Paxlovid to actively collect and report safety information on the drug and has improved related systems so that medical experts, as well as patients receiving treatment at residential treatment centers and homes, may report their side effects.
Also, through continuous analysis·assessment of safety information on Paxlovid in Korea and abroad, the authorities will make the safety measures necessary including precautions, discontinuations, and recalls.
With patient safety as a top priority, the authorities plan to take measures such as compensating for damages after evaluating the causality of the side effects that may occur.
An MFDS official said, “The drug may be used with doctors’ prescriptions.
However, as it is an oral pill rather than a shot, it will be distributed through pharmacies and supplied to patients that receive treatments at home.” Meanwhile, Paxlovid received emergency use authorization from the US FDA on the 22nd.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










