- LOGIN
- MemberShip
- 2025-12-23 16:20:20
- GBP510 has been approved for Phase 3, the 1st time in Korea
- by Lee, Tak-Sun | translator Choi HeeYoung | 2021-08-17 05:52:11
Domestic developed COVID-19 vaccine has entered the final stage of commercialization.
A candidate for the COVID-19 vaccine developed by SK Bioscience will conduct phase 3 clinical trial.
The MFDS announced on Tuesday that it approved phase 3 clinical trial plan for the first domestic COVID-19 vaccine after thoroughly verifying its safety and scientific feasibility.
With the approval, COVID-19 vaccine developed by a Korean company will enter phase 3 clinical trial for the first time.
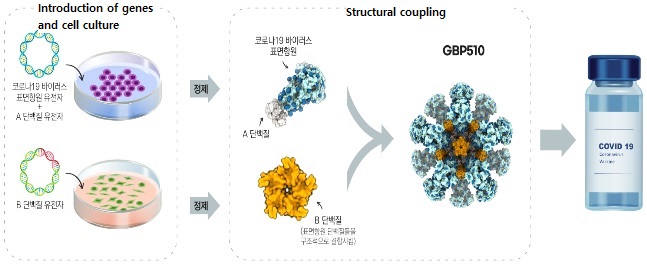
GBP510 is a recombinant vaccine that injects surface antigen protein of the coronavirus created using genetic recombination technology to induce immune response, stimulating immune cells in the body and neutralizing and eliminating the virus when it enters the body.
This vaccine has been developed to enhance immune effectiveness by generating a large number of antibodies, especially by utilizing techniques that increase antigen exposure.
The three-phase clinical trial approved this time is a clinical trial to evaluate the immune origin and safety of GBP510 for adults aged 18 and older.
phase 3 clinical trial is conducted in a comparative clinical manner using Astrazeneca COVID-19 vaccine stocks, which are licensed in Korea and used for vaccination, as a control group.
As a control group, AstraZeneca COVID-19 Vacine was selected, considering the absence of a licensed COVID-19 recombinant vaccine.
and was designed to confirm the superiority of neutral antibodies and the non-equivalence of serum reactions.
Neutralized antibodies are the amount of antibodies that can neutralize a particular virus, and the serum reaction rate is the percentage of test subjects whose antibody price increases more than four times compared to before vaccination.
The total number of test subjects is 3,990, 3,000 for the test vaccine, and 990 for the control group will be vaccinated twice every four weeks with 0.5 mg each, and safety and immunogenicity will be evaluated.
Phase 3 will be conducted simultaneously not only in Korea but also in Southeast Asia and Eastern Europe.
Phase 3 clinical trial is a test to verify the safety and validity of a drug, and its validity is reviewed based on the results of a prior clinical trial, quality of a clinical drug, non-clinical data, etc.
In the case of GBP510, phase 2 is currently in progress, but phase 1 showed sufficient safety and immunogenicity, showing the possibility of entering phase 3.
After phase 1 and phase 2 was approved on January 26, a phase 1 clinical trial was conducted on 80 healthy adults (ages 19 to 55 years old) and a phase 2 clinical trial is underway on 240 people.
As a result of phase 1 intermediate analysis, neutralized antibodies were produced in all vaccinators in terms of efficacy, which was more than five times higher than that of the International Standard Serum (perfection and autoclave).
No special side effects have been reported other than cases (injection pain, fatigue, muscle pain, headache, etc.) that are common when vaccinated.
In addition, the MFDS explained that it reviewed non-clinical test data such as reproductive toxicity and animal model attack tests, and quality data such as batch analysis results.
The MFDS held an advisory meeting with clinical experts on the 9th and consulted on the appropriateness of the evidence data and feasibility of the clinical trial plan to enter phase 3.
The MFDS said the approval of the clinical trial is meaningful that it has taken the first step toward self-sufficiency of the domestic vaccine as the first domestic vaccine enters phase 3 amid the coronavirus epidemic.
Even though there is no global vaccine leader, it approved phase 3 clinical trials for the development of the COVID vaccines in Korea, and even before the establishment of the Immunological Correlate of Protection (ICP), it introduced a comparative clinical method with active and close screening.
Immunological Correlate of Protection(ICP) is most commonly defined as a type and amount of immunological response that correlates with vaccine-induced protection against a clinically apparent infectious disease and that is consider The MFDS stressed that it will continue to communicate with the clinical site after the product's clinical approval so that clinical trials can proceed smoothly, and other products that are undergoing clinical trials in Korea can quickly enter phase 3.
It also added that it will thoroughly monitor safety issues such as unexpected adverse reactions of clinical trial participants and medication information that affects clinical trials, and make sure clinical trials are carried out safely.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









