- LOGIN
- MemberShip
- 2025-12-19 03:02:08
- MFDS' pharma policy keyword, 'shorten time'
- by Lee, Hye-Kyung | translator Hong, Ji Yeon | 2025-01-21 05:54:31
According to the business plan announced by the Ministry of Food and Drug Safety (MFDS) this year, support policy to facilitate quick market entry for new drugs and innovative products stands out.
The 'Ministry of Food and Drug Safety's Major Policy Implementation Plan for 2025' announced on January 21 by the MFDS contains its aim to shorten the duration of development to commercialization using various systems.
First, the MFDS will newly establish a dedicated review team this year to provide expert consultation services at each approval stage.

The MFDS will prioritize document review and GMP site monitoring and plan to shorten the approval duration from 420 to 295 days.
The MFDS will implement a priority review policy to expand the number of interview consultations (3→10) and prioritize the review of a document that requires supplementation as soon as it is completed.
Additionally, the MFDS will improve the expetise of the review panel and regulatory capacity by continuosly expanding the percentage of experts within the review panel, including doctors and pharmacists, developing educational programs for the latest technologies, and conducting training programs customized to the panel's work experience (basic·core·intensive).
Notably, companies can apply for a single pre-registration consultation session before applying for a new drug marketing authorization.
It has been reported that two consultation sessions have been held to date.
Kim Sang Bong, Director of the Pharmaceutical Safety Bureau, stated during the briefing held on January 20, "We have held two pre-registration consultation sessions until today." Kim added, "Yet, we do not have a record of the new drug application that was submitted." "The MFDS announced a documented plan for a procedure that is equivalent to the level of new drug assessment in advanced pharmaceuticals countries such as the U.S.
and Europe," Kim said.
"To efficiently run the annouced process, we will assign review panels and expand expert personnel with a strong background." Starting in April, the MFDS will implement a regulatory suitability review system where innovative product R&D research as part of government R&D projects will be selected and provide regulatory requirements, process, and commercialization strategy.
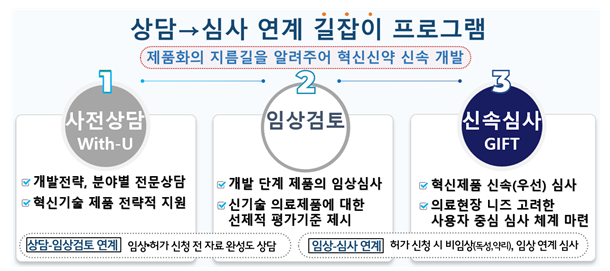
"The MFDS will implement a 'Path Program' linking the With-U prior-registration consultation, clinical trial review, and GIFT expedited review," Kim said.
"Previously, we received a review that each program runs without smooth transition, so we designed a program to overlook the transition." The 'Path Program' is projected to shorten the time for innovative product development to commercialization.
Kim stated, "We cannot guarantee that the time will greatly reduce, but the program has the advantage in terms of predictability and transparency."

Starting in April, to prepare for the pharmaceutical supply shortage, the MFDS will set a preliminary report date of 180 days before the supply discontinuation of production and imports by pharmaceutical production·import companies and mandate reporting of supply shortage.
"The government is in the process of establishing a safety network for efficient transaction between various policies, including national essential drugs, private-public committee for supply shortage, and consignment production·production by orders," Kim said.
"Reporting of supply shortage is one of the advanced measures." "The pharmaceutical industry may take these updates as another regulatory measure, but the intent of these policies is to predict supply shortage in advance and to secure time for each policy measure to run smoothly," Kim said.
"The MFDS aims to prevent supply shortage in advance and allow companies to receive administrative support."
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










