- LOGIN
- MemberShip
- 2025-12-25 01:06:58
- Amendment to cascading drug price revision revealed
- by Kim, Jung-Ju | translator Choi HeeYoung | 2020-01-30 06:33:47
Finally came the result.
The reinstatement of the cascading drug price system was revised and revised to change the generic insurance price according to whether or not it had its own bioequivalence test.
As is known, there is a difference in the price of IMDs and generics.
Revisions were included to keep the addition in recognition of the effort and innovation.
However, in the case of listed drugs, the application sentence linking permit and drug prices after three years of preparation period is missing from the readministrative notice.
This was confirmed that there would be no change as a result of the planned re-evaluation process (3 years) to be carried out through a re-evaluation procedure separately announced according to the 'Criteria for Decision or Adjustment on Drugs'.
The Ministry of Health and Welfare announced ‘a partial revision of the Criteria for Decision or Adjustment on Drugs’ today (Jan 28) morning and looked up opinion in the industry.
When the first notice amendment was issued on July 2 last year, the government decided to revise the notice in early September and enter into full-scale implementation this year.
However, due to the high impact of drug price reform, some additions were inevitable due to continued protests and protests.
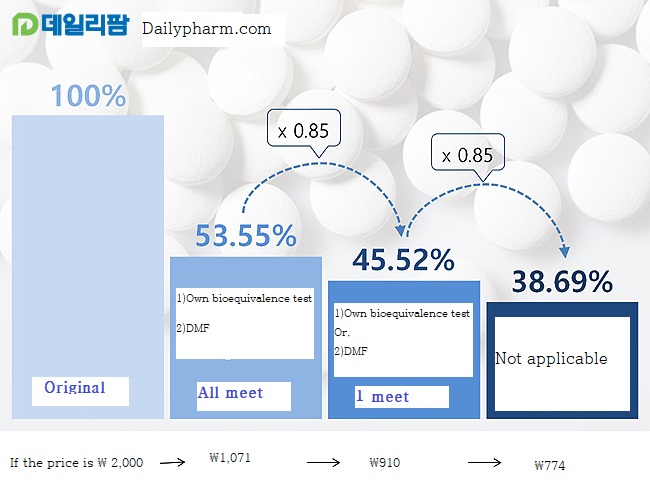
The revised bill for the price standard system, which cuts the generic price by 15% according to its own and co-prosperity into 'stairs' and limits the same number of generics as the so-called 'cut line', was also included in the revised proposal.
In detail, a new set of criteria for applying differential prices (submission of biometric data or evidence of clinical trials and the use of registered ingredients) has been established.
The cascading reorganization will change the price of the drug depending on the criteria, provided that the same formulations are listed under 19 products.
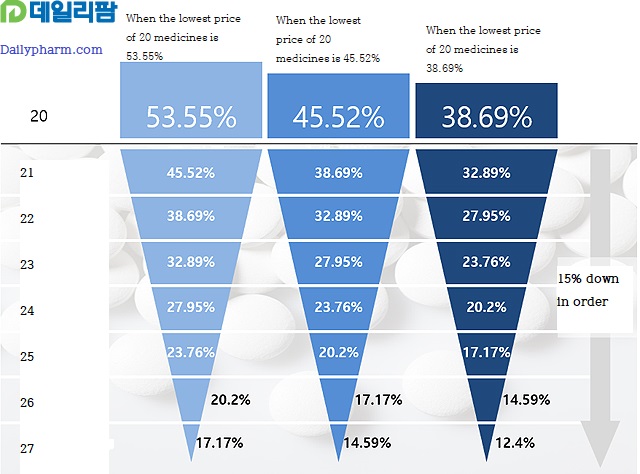
53.55% if all are met, 45.52% if only one is met, and 38.69% if there is no requirement.
In the case of 'A cut off point system', when more than 20 products of the same formulations are listed, it is calculated automatically 85% of the lower amount between the lower price of the upper limit of the same system and the amount calculated as 38.69%.
Eye drops are also multi-use or single-use eye drops.
However, if the applied product is a single-use or multi-use product, the calculation criteria will be pushed forward.
However, if the applied product is a single-use or multi-use product, the calculation criteria will be pushed forward.
If revised, it will take effect on July 1st.
◆Reorganization of Addition System= The industry's current focus is on this reform.
The reorganization plan includes all the contents of the first draft made last year, including the comprehensive maintenance of synthetic and biologic drugs, and the extension of the period of addition.
Looking specifically at the addition of IMDs, the IMD maintains the addition until the IMD or the individual single or complex constituting the product and the same route of administration, ingredient, and formulation are listed.
This includes IMD complexes.
Just this has a condition.
Excludes two or more listed companies that have the same dosage, route, ingredient, and formulation as the individual single compound and compound listed in the combination.
Also, products added after the addition period has passed cannot be added.
In addition, the addition requirements for both synthetic (chemical) and biologics are the same as those published last year.
The addition period and the number of companies that have been set for each standard have been unified and maintained.
Specifically, the period for adding synthetic and biopharmaceuticals is one year, and if the number of companies is three or less, the period for adding and maintaining all of them is up to two years.
However, if the pharmaceutical company wants to extend the addition period, the government prepared a system to adjust the addition rate and extend the addition period within the two-year limit through the review of the Pharmaceutical Benefits Advisory Committee.
The government plans to implement this addition system by January 17, next year after receiving opinions.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









