- LOGIN
- MemberShip
- 2025-12-25 04:43:40
- HIRA rejects reimbursed use of Spinraza on 14-year-old
- by Lee, Hye-Kyung | translator Byun Kyung A | 2019-12-03 05:53:45
Approval on reimbursed use of Spinraza (nusinersen) on a 14-year-old male patient with 5q spinal muscular atrophy (SMA) was denied.
The application submitted by the hospital was rejected as it did not clarify if the patient had developed clinical symptoms of SMA before 36 months.
On Nov.
29, Health Insurance Review and Assessment (HIRA, President Kim Seung-taek) posted seven cases of Treatment Review and Evaluation Committee deliberation in October.

In last month, 15 preliminary drug use approval applications on Spinraza, including 13 first loading doses and two maintenance doses (application submitted once every four months), were submitted.
But the committee disapproved only one case, which involved a 14-year-old boy.
Other 11 first loading doses and two maintenance doses were approved, and one first loading dose was approved with conditions.
The conditional approval was granted to a five-month-old female infant trying to get detached from ventilator.
The committee approved of reimbursed use of Spinraza as long as the patient submits medical profession’s statement on use of ventilator prior to Spinraza administrations and medical record of respiratory function.
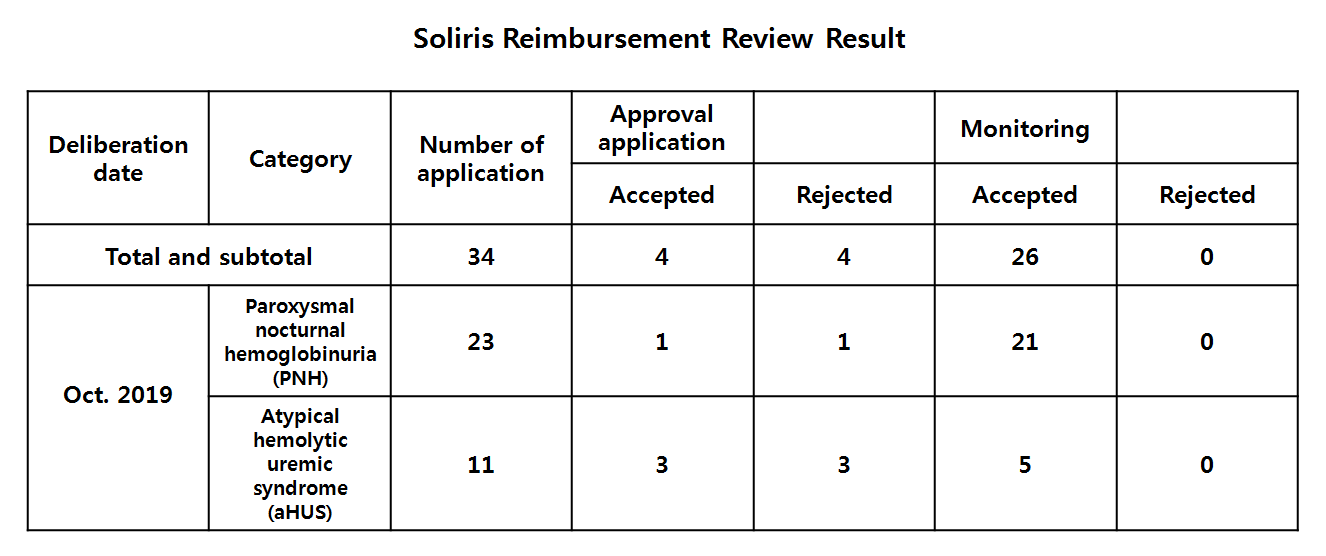
For the first loading dose, one PNH case was accepted and other one was rejected.
Whereas three cases of aHUS patients were accepted and other three were rejected.
Use of Soliris on a PNH case denied as the patient’s medical record was missing repetitive abdominal pain-induced hospital administration, but showed a recent increase in use of narcotic analgesic.
The patient’s record did not meet scope of reimbursed use of the treatment.
An aHUS case was rejected because the patient’s status was not clear cut as stated in the criteria.
The patient’s symptom was considered as a secondary thrombotic microangiopahty induced from rheumarthritis and its treatment, and from multiple myeloma and its treatment.
And also the patient showed rise of CEA level, delayed prothrombin time and activated partial thromboplastin time (PT/aPTT), and fall of fibrinogen level.
The committee also decided the patient cannot expect positive effect from the treatment as the patient needs dialysis for end-stage renal disease.
A preliminary approval review on reimbursed ventricular assist device (VAD) treatment was conducted as well.
A male patient aged 64 years was registered on the heart implant waiting list with dilated cardiomyopathy (DCM), who was diagnosed with end-stage heart failure by an echocardiography with dobutamine substance and motor function test.
The patient did not recover from medication treatment and is dependent on intravenous cardiotonic agent.
HIRA approved reimbursement on the patient’s VAD treatment, because the case met the reimbursement standard of ‘indication for VAD implant on end-stage heart failure patient, who has been registered on heart implant waiting list as a makeshift treatment’.
Also the patient not showing any contraindication helped the decision.
Other details of the Treatment Review and Evaluation Committee’s October meeting can be found on HIRA website (www.hira.or.kr).
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









