총 283건
-
제이비케이랩·세포교정의약학회, NAPA서 OCNT 소개[데일리팜=최다은 기자] 단순한 수명 연장을 넘어 인체의 생물학적 시계를 되돌리는 ‘역노화(Reverse-Aging)’가 글로벌 의학계의 핵심 화두로 떠오르고 있다. 이러한 패러다임 전환 속에서 지난 1월 7일부터 9일까지 전남 여수에서 열린 ‘제13회 NAPA 국제 컨퍼런스’는 항노화를 넘어선 차세대 의학적 접근을 조망하는 학술 교류의 장으로 주목받았다. 특히 세포교정의약학회(OMPA)와 제이비케이랩(대표 장봉근)이 공동 주관한 ‘셀메드(Session)’는 국내 약사들이 임상 현장에서 축적해온 세포교정영양요법(OCNT)의 데이터를 세계 학계에 공개하며, 역노화가 이론을 넘어 실증 단계에 진입했음을 부각시켰다. 학술적 논의는 8일 진행된 런천 세션을 기점으로 한층 심화됐다. 이번 학술대회를 이끈 서영준 서울대학교 약학대학 명예교수는 글로벌 연구자들을 대상으로 세포교정영양요법의 학문적 가치와 향후 비전에 대한 통찰을 제시하며 세션의 중심을 잡았다. 서 교수는 세포교정의약학회(OMPA)의 공식 학술지인 ‘셀메드(CELLMED)’를 직접 소개하며 다학제 연구 플랫폼으로서의 역할을 강조했다. 그는 “CELLMED는 의학, 약학, 임상의학, 예방의학은 물론 인문학과의 융합 연구까지 포괄하는 학술지”라며, 혁신적인 치료 사례와 연구 성과에 대한 국내외 연구자들의 적극적인 참여를 독려했다. 이어 발표에 나선 지은실 약사(세포교정의약학회 LMS 본부장·현대약국)는 암세포가 생존을 위해 정상 신호 경로를 왜곡한 상태인 ‘비종양 유전자 중독(Non-oncogene addiction)’을 안토시아닌과 후코이단을 결합한 나노컴플렉스로 완화할 수 있다는 기전을 소개했다. 특히 독자적인 ‘이온파이(Ion-Pi) 결합 기술’을 통해 생물학적 이용률을 극대화함으로써, 이론적 연구를 실제 임상 효능으로 연결한 점이 주목받았다. 이 같은 기술적 접근은 9일 오전 진행된 셀메드 메인 세션에서 구체적인 임상 성과로 이어졌다. 서영준 서울대 약대 명예교수와 정선용 아주대 의과대학 의학유전학과 교수가 좌장을 맡은 가운데, 국내 약국 현장에서 축적된 실제 임상 사례들이 연이어 발표됐다. 조종빈 약사(셀메드화순종로약국)는 반복된 체외수정 실패를 겪은 난임 환자가 OCNT 적용 후 체내 염증 환경이 개선돼 자연 임신과 출산에 성공한 사례를 공유했다. 박정아 약사(인제약국)는 췌장암 수술 이후 발생한 당뇨 합병증이 OCNT를 통해 정상 범위로 회복된 사례를, 이아영 약사(365올리브약국)는 고령 환자의 2단계 욕창이 세포교정영양요법 후 완전 회복에 이른 사례를 각각 발표했다. 이와 함께 서연희 약사(명성온누리약국)는 10년 이상 지속된 만성 질환 환자가 OCNT 이후 임상적으로 정상 소견을 받은 사례를 통해 맞춤형 영양요법의 가능성을 제시했고, 신재명 약사(하나로약국)는 중증 건선 환자의 증상이 단기간 내 완화된 임상 데이터를 공개해 주목을 받았다. 해당 임상 결과는 일본 니가타대학의 면역학자 소마 겐이치로 교수의 발표를 통해 과학적 근거가 보강됐다. 소마 교수는 점막을 통해 활성화된 대식세포가 전신을 순환하며 조직 회복을 유도하는 ‘대식세포 네트워크’ 개념을 설명하며, 구강 및 피부 점막을 통한 LPS 자극이 인지 기능 개선과 피부 재생에 기여할 수 있다는 기전을 제시했다. 세션의 마지막 발표자로 나선 장봉근 제이비케이랩 대표는 세계보건기구(WHO)가 노화에 질병 코드(MG2n)를 부여하며 노화를 ‘치료 가능한 대사 기능 저하’로 규정한 최근 흐름을 소개했다. 그는 NAD 대사를 중심으로 한 ‘NMN PLEX’ 전략을 공개하며, 에너지 대사를 보충하는 연료(Fuel) 단계, 시르투인 신호를 활성화하는 점화(Ignition) 단계, 그리고 항상성 회복과 재생 신호를 유도하는 재건(Builder) 단계로 이어지는 다층적 역노화 메커니즘을 설명했다. 장 대표는 “이번 NAPA 국제 컨퍼런스는 국내 약사들이 축적해온 임상 데이터와 OCNT의 체계적 메커니즘이 글로벌 메디컬 트렌드와 맞닿아 있음을 확인한 자리였다”며 “국제 학술 무대에서의 검증을 계기로, 세포교정영양요법이 건강 수명 연장을 위한 글로벌 표준으로 자리 잡을 수 있도록 연구개발을 지속해 나가겠다”고 밝혔다.2026-01-14 13:58:06최다은 기자
-
 송윤선 숙명약대 교수, 대한뇌혈류대사학회장에[데일리팜=강혜경 기자]송윤선 숙명여자대학교(총장 문시연) 약학대학 교수가 대한뇌혈류대사학회(KSCBFM) 제2대 회장에 선출됐다. 대한뇌혈류대사학회는 뇌혈류·대사 분야의 연구 활성화와 학문 발전을 위해 기초·임상·공학 분야 연구자들이 참여하는 융합 연구의 장이다. 송 교수는 기초의과학과 뇌과학을 잇는 연구 역량을 꾸준히 쌓으며 학제 간 협력과 국제 교류에도 적극 참여해 왔다. 그는 초대 회장인 KAIST 바이오 및 뇌공학과 정용 교수와 함께 공동위원장을 맡아 'Brain & Brain PET 2025' 학술대회를 치렀다. 송윤선 교수는 "약대 교수로서 축적해 온 뇌 연구 경험과 대외협력 역량을 바탕으로 학회가 기초 연구와 임상 적용을 연결하는 실질적인 플랫폼이 되도록 힘쓰겠다"며 "국내 연구자 간 협력은 물론 해외 학회, 국제 네트워크와의 연계를 강화해 우리나라 뇌혈류대사 연구가 세계 무대에서 영향력을 발휘할 수 있도록 방향을 제시해 나가겠다"고 말했다.2026-01-13 17:01:30강혜경 기자
송윤선 숙명약대 교수, 대한뇌혈류대사학회장에[데일리팜=강혜경 기자]송윤선 숙명여자대학교(총장 문시연) 약학대학 교수가 대한뇌혈류대사학회(KSCBFM) 제2대 회장에 선출됐다. 대한뇌혈류대사학회는 뇌혈류·대사 분야의 연구 활성화와 학문 발전을 위해 기초·임상·공학 분야 연구자들이 참여하는 융합 연구의 장이다. 송 교수는 기초의과학과 뇌과학을 잇는 연구 역량을 꾸준히 쌓으며 학제 간 협력과 국제 교류에도 적극 참여해 왔다. 그는 초대 회장인 KAIST 바이오 및 뇌공학과 정용 교수와 함께 공동위원장을 맡아 'Brain & Brain PET 2025' 학술대회를 치렀다. 송윤선 교수는 "약대 교수로서 축적해 온 뇌 연구 경험과 대외협력 역량을 바탕으로 학회가 기초 연구와 임상 적용을 연결하는 실질적인 플랫폼이 되도록 힘쓰겠다"며 "국내 연구자 간 협력은 물론 해외 학회, 국제 네트워크와의 연계를 강화해 우리나라 뇌혈류대사 연구가 세계 무대에서 영향력을 발휘할 수 있도록 방향을 제시해 나가겠다"고 말했다.2026-01-13 17:01:30강혜경 기자 -
 7월부터 공인 학술대회만 후원 허용…우회·중복 지원도 금지[데일리팜=김진구 기자] 이름뿐인 '국제학술대회'에 대한 지원이 차단된다. 올해 7월부터 의사회·약사회 등 전문가단체의 인정을 받은 국제학술대회에만 지원이 가능하다. 학술대회 지원 시 추가적인 식음료 제공·부스 임대·광고의 중복 제공이 금지된다. 부스 판촉물은 1만원 이하 펜과 노트패드로 한정된다. 제품명 노출은 금지하되 회사명 노출은 허용한다. 한국제약바이오협회는 최근 이같은 내용을 골자로 하는 ‘의약품 거래에 관한 공정경쟁규약’(5차 개정)을 공정거래위원회로부터 승인받았다. 개정 공정경쟁규약은 학술대회의 탈을 쓴 각종 ‘유사 학술대회’와 우회적 지원 관행을 차단하는 데 초점이 맞춰졌다. 이번 개정으로 학술대회와 제품설명회, 전시·광고의 경계가 명확해졌고, 학술대회 중 제품설명회와 위성 심포지엄을 활용한 지원 방식에 사실상 제동이 걸렸다는 평가다. ◆형식적 국제행사 차단 = 개정 공정경쟁규약은 ‘국내 개최 국제학술대회’의 정의를 신설했다. 국제학술대회라는 명칭을 사용하기 위해선 의사회·약사회 등이 정한 심사 기준을 통과해야 한다. 심사 기준에는 ▲외국인 참가자 수 ▲학술대회 프로그램의 국제화 수준 ▲연간 신청 건수 ▲학술대회 프로그램의 내실화 정도가 포함돼야 한다. 이와 함께 2일 이상 국제 규모의 학술대회로 국내에서 진행돼야 하며, 5개국 이상·50명 이상 외국 보건의료전문가(주관자 참석 지원·초청 연자 제외)가 현장 참가해야 한다. 또한 한국제약바이오협회에 예산·결산 내역을 제출해야 한다. 단, 희귀질환 관련 국제학술대회는 5개국 이상 또는 50명 이상 요건 중 하나만 충족해도 된다. 협회는 국내 개최 국제학술대회가 계획에 따라 적정하게 개최됐는지 확인할 수 있도록, 비용 결산 내역과 기타 증빙자료를 행사 종료 후 90일 내에 제출하도록 사전 고지한다. 학술대회 주관 단체가 이를 거절할 경우 협회는 학술대회 지원 절차를 중단할 수 있도록 했다. 그간 국제학술대회라는 외형을 갖췄지만 실질적으로는 국내 학술행사에 가까운 사례들이 적지 않았던 만큼, 이번 기준 명문화는 형식적·편법적 국제행사를 걸러내기 위한 장치로 해석된다. ◆학술대회 쪼개기 지원 금지 = 학술대회 개최·운영 지원 방식도 한층 엄격해졌다. 제약사가 학술대회를 지원할 경우, 해당 학술대회와 관련한 ▲기부 ▲식음료 제공 ▲부스 임대 ▲광고 등을 중복 제공하지 못한다. 학술대회 중 진행되는 제품설명회는 ‘별도 행사’로 인정하지 않는다. 새 규약은 학술대회 중 개최되는 제품설명회를 학술대회의 일부로 간주하고, 이에 대한 지원은 학술대회 관련 규정인 제8조·제9조를 적용하도록 명확히 했다. 이에 따라 학술대회 기간 동안 열리는 위성 심포지엄, 런천 세션 등을 제품설명회로 분리해 별도 지원하는 방식은 사실상 불가능해졌다. 학술대회 기간 중 중복·우회 지원 관행을 차단하겠다는 취지로 풀이된다. 학술대회 주관 단체는 개최 90일 전까지 제약바이오협회에 지원을 신청해야 하며, 협회는 위반 소지가 있을 경우 소명이나 시정을 요구하고, 미이행 시 지원 절차를 중단할 수 있다. ◆‘최대 300만원’ 부스비 기준 신설 = 전시·광고 부스 운영과 관련한 기준이 새로 마련됐다. 학회 주최 학술대회의 부스비는 건당 200만~300만원, 요양기관 주최 학술대회는 건당 50만~100만원으로 설정됐다. 단, 부스비는 물가상승률 등을 고려하여 조정할 수 있으며 이때 공정거래위원회의 심사를 사전에 받아야 한다. 부스비 지급이 허용되는 학술대회는 의·약학 연수평점 3점(최소 3시간) 이상이면서, 보건의료전문가 50명 이상(희귀질환 학회는 25명)이 참석하는 행사로 한정된다. ◆판촉물은 ‘펜·노트’로 한정 = 자사 제품설명회와 관련한 판촉물 기준도 강화됐다. 식음료 외에는 원칙적으로 어떠한 금품류도 제공할 수 없다. 예외적으로 펜과 노트패드만 허용된다. 이때 펜과 노트의 합산가액은 약사법 시행규칙 별표2 기준에 따라 1만원을 넘을 수 없다. 펜과 노트에는 제품명 표기가 금지된다. 다만 회사명은 표기할 수 있다. ◆식대·교통비 명문화 = 학술대회 참가자 식대·교통비 기준이 더욱 명확해졌다. 국내 개최 학술대회의 경우 학술대회 참석 일수에 따라 1일 3식까지 지원할 수 있으며, 개최 지역 내 식당에서 개인카드나 현금으로 결제한 영수증을 증빙해야 한다. 1식당 지원 한도는 최대 5만원으로, 실비 지원 원칙이 적용된다. 해외 개최 학술대회는 공무원 여비규정에 따른 국가·도시별 등급을 기준으로 식대가 정액화됐다. 가등급은 1일 10만원, 나등급 8만원, 다등급 6만원, 라등급 5만원으로 구분된다. 해외 학술대회 관련 현지 교통비 지원 기준도 변경됐다. 기존에는 공항-호텔, 숙소-행사장 이동 등 실비 기준으로 최대 15만원까지 지원할 수 있었다. 개정 후에는 학술대회당 10만원을 정액으로 지원할 수 있다. 형식적 국제행사 차단, 학술대최 쪼개기 지원 금지, 부스비 기준 신설은 올해 7월 1일부터 적용된다. 판촉물을 펜과 노트로 한정한 내용과 식대·교통비 관련 내용은 올해 1월 1일부터 즉시 적용된 상태다. 이밖에 이번 개정에서는 관련 법령 개정에 따라 CSO와 지출보고서 제도와 관련한 내용도 새로 반영됐다. 제약사는 회계연도 종료 후 3개월 이내에 약사·한약사·의료인·의료기관 개설자 또는 의료기관 종사자에게 경제적 이익 등 내역에 관한 지출보고서를 작성해 공개하고 해당 지출보고서와 관련 장부, 근거 자료를 5년간 보관해야 한다는 내용이 신설됐다. 의약품 판촉영업자에 약사법에 규정된 의약품공급자(의약품 품목허가를 받은 자, 수입자 또는 의약품 도매상) 뿐만 아니라 ‘의약품 판매촉진 업무를 위탁받은 자 및 이들로부터 재위탁을 받은 자’도 새롭게 포함됐다. 제약사나 도매업체로부터 영업 대행을 위탁받은 CSO 업체들도 공정거래규약의 판촉 업무 규제를 받을 수 있다는 내용이 구체화됐다.2026-01-09 12:14:47김진구 기자
7월부터 공인 학술대회만 후원 허용…우회·중복 지원도 금지[데일리팜=김진구 기자] 이름뿐인 '국제학술대회'에 대한 지원이 차단된다. 올해 7월부터 의사회·약사회 등 전문가단체의 인정을 받은 국제학술대회에만 지원이 가능하다. 학술대회 지원 시 추가적인 식음료 제공·부스 임대·광고의 중복 제공이 금지된다. 부스 판촉물은 1만원 이하 펜과 노트패드로 한정된다. 제품명 노출은 금지하되 회사명 노출은 허용한다. 한국제약바이오협회는 최근 이같은 내용을 골자로 하는 ‘의약품 거래에 관한 공정경쟁규약’(5차 개정)을 공정거래위원회로부터 승인받았다. 개정 공정경쟁규약은 학술대회의 탈을 쓴 각종 ‘유사 학술대회’와 우회적 지원 관행을 차단하는 데 초점이 맞춰졌다. 이번 개정으로 학술대회와 제품설명회, 전시·광고의 경계가 명확해졌고, 학술대회 중 제품설명회와 위성 심포지엄을 활용한 지원 방식에 사실상 제동이 걸렸다는 평가다. ◆형식적 국제행사 차단 = 개정 공정경쟁규약은 ‘국내 개최 국제학술대회’의 정의를 신설했다. 국제학술대회라는 명칭을 사용하기 위해선 의사회·약사회 등이 정한 심사 기준을 통과해야 한다. 심사 기준에는 ▲외국인 참가자 수 ▲학술대회 프로그램의 국제화 수준 ▲연간 신청 건수 ▲학술대회 프로그램의 내실화 정도가 포함돼야 한다. 이와 함께 2일 이상 국제 규모의 학술대회로 국내에서 진행돼야 하며, 5개국 이상·50명 이상 외국 보건의료전문가(주관자 참석 지원·초청 연자 제외)가 현장 참가해야 한다. 또한 한국제약바이오협회에 예산·결산 내역을 제출해야 한다. 단, 희귀질환 관련 국제학술대회는 5개국 이상 또는 50명 이상 요건 중 하나만 충족해도 된다. 협회는 국내 개최 국제학술대회가 계획에 따라 적정하게 개최됐는지 확인할 수 있도록, 비용 결산 내역과 기타 증빙자료를 행사 종료 후 90일 내에 제출하도록 사전 고지한다. 학술대회 주관 단체가 이를 거절할 경우 협회는 학술대회 지원 절차를 중단할 수 있도록 했다. 그간 국제학술대회라는 외형을 갖췄지만 실질적으로는 국내 학술행사에 가까운 사례들이 적지 않았던 만큼, 이번 기준 명문화는 형식적·편법적 국제행사를 걸러내기 위한 장치로 해석된다. ◆학술대회 쪼개기 지원 금지 = 학술대회 개최·운영 지원 방식도 한층 엄격해졌다. 제약사가 학술대회를 지원할 경우, 해당 학술대회와 관련한 ▲기부 ▲식음료 제공 ▲부스 임대 ▲광고 등을 중복 제공하지 못한다. 학술대회 중 진행되는 제품설명회는 ‘별도 행사’로 인정하지 않는다. 새 규약은 학술대회 중 개최되는 제품설명회를 학술대회의 일부로 간주하고, 이에 대한 지원은 학술대회 관련 규정인 제8조·제9조를 적용하도록 명확히 했다. 이에 따라 학술대회 기간 동안 열리는 위성 심포지엄, 런천 세션 등을 제품설명회로 분리해 별도 지원하는 방식은 사실상 불가능해졌다. 학술대회 기간 중 중복·우회 지원 관행을 차단하겠다는 취지로 풀이된다. 학술대회 주관 단체는 개최 90일 전까지 제약바이오협회에 지원을 신청해야 하며, 협회는 위반 소지가 있을 경우 소명이나 시정을 요구하고, 미이행 시 지원 절차를 중단할 수 있다. ◆‘최대 300만원’ 부스비 기준 신설 = 전시·광고 부스 운영과 관련한 기준이 새로 마련됐다. 학회 주최 학술대회의 부스비는 건당 200만~300만원, 요양기관 주최 학술대회는 건당 50만~100만원으로 설정됐다. 단, 부스비는 물가상승률 등을 고려하여 조정할 수 있으며 이때 공정거래위원회의 심사를 사전에 받아야 한다. 부스비 지급이 허용되는 학술대회는 의·약학 연수평점 3점(최소 3시간) 이상이면서, 보건의료전문가 50명 이상(희귀질환 학회는 25명)이 참석하는 행사로 한정된다. ◆판촉물은 ‘펜·노트’로 한정 = 자사 제품설명회와 관련한 판촉물 기준도 강화됐다. 식음료 외에는 원칙적으로 어떠한 금품류도 제공할 수 없다. 예외적으로 펜과 노트패드만 허용된다. 이때 펜과 노트의 합산가액은 약사법 시행규칙 별표2 기준에 따라 1만원을 넘을 수 없다. 펜과 노트에는 제품명 표기가 금지된다. 다만 회사명은 표기할 수 있다. ◆식대·교통비 명문화 = 학술대회 참가자 식대·교통비 기준이 더욱 명확해졌다. 국내 개최 학술대회의 경우 학술대회 참석 일수에 따라 1일 3식까지 지원할 수 있으며, 개최 지역 내 식당에서 개인카드나 현금으로 결제한 영수증을 증빙해야 한다. 1식당 지원 한도는 최대 5만원으로, 실비 지원 원칙이 적용된다. 해외 개최 학술대회는 공무원 여비규정에 따른 국가·도시별 등급을 기준으로 식대가 정액화됐다. 가등급은 1일 10만원, 나등급 8만원, 다등급 6만원, 라등급 5만원으로 구분된다. 해외 학술대회 관련 현지 교통비 지원 기준도 변경됐다. 기존에는 공항-호텔, 숙소-행사장 이동 등 실비 기준으로 최대 15만원까지 지원할 수 있었다. 개정 후에는 학술대회당 10만원을 정액으로 지원할 수 있다. 형식적 국제행사 차단, 학술대최 쪼개기 지원 금지, 부스비 기준 신설은 올해 7월 1일부터 적용된다. 판촉물을 펜과 노트로 한정한 내용과 식대·교통비 관련 내용은 올해 1월 1일부터 즉시 적용된 상태다. 이밖에 이번 개정에서는 관련 법령 개정에 따라 CSO와 지출보고서 제도와 관련한 내용도 새로 반영됐다. 제약사는 회계연도 종료 후 3개월 이내에 약사·한약사·의료인·의료기관 개설자 또는 의료기관 종사자에게 경제적 이익 등 내역에 관한 지출보고서를 작성해 공개하고 해당 지출보고서와 관련 장부, 근거 자료를 5년간 보관해야 한다는 내용이 신설됐다. 의약품 판촉영업자에 약사법에 규정된 의약품공급자(의약품 품목허가를 받은 자, 수입자 또는 의약품 도매상) 뿐만 아니라 ‘의약품 판매촉진 업무를 위탁받은 자 및 이들로부터 재위탁을 받은 자’도 새롭게 포함됐다. 제약사나 도매업체로부터 영업 대행을 위탁받은 CSO 업체들도 공정거래규약의 판촉 업무 규제를 받을 수 있다는 내용이 구체화됐다.2026-01-09 12:14:47김진구 기자 -
 다가오는 검증의 시간...K-바이오, 글로벌 경쟁력 시험대[데일리팜=차지현 기자] 올해 글로벌 시장에서 국내 바이오벤처의 연구개발(R&D) 성과가 본격 시험대에 오른다. 에이비엘바이오는 설립 이후 처음으로 기술수출 파이프라인이 상업화 가능성을 검증받는 단계에 진입했다. 리가켐바이오와 디앤디파마텍, 에이프릴바이오 등도 글로벌 파트너사와 함께 주요 기술수출 자산의 임상 데이터를 잇따라 공개할 예정이다. 코오롱티슈진은 오는 6월 핵심 파이프라인의 임상 3상 결과 공개를 앞뒀다. ABL바이오, 첫 로열티 신약 눈앞…ABL001 2/3상 최종 데이터 공개 예정 8일 바이오 업계에 따르면 올 1분기 에이비엘바이오는 파트너사 미국 컴퍼스 테라퓨틱스를 통해 담도암 치료제 후보물질 'ABL001'(CTX-009·성분명 토베시미그)의 임상 2/3상 최종 결과를 발표할 예정이다. 컴퍼스는 해당 데이터를 바탕으로 올 하반기께 미국 식품의약국(FDA)에 생물의약품허가(BLA) 신청 절차에 착수할 것으로 점쳐진다. ABL001은 신생혈관 형성에 관여하는 혈관내피성장인자(VEGF)와 델타 유사 리간드 4(DLL4)를 동시에 억제하는 이중항체 기반 바이오 신약이다.VEGF는 종양이 성장하는 데 필요한 혈관을 새로 만드는 핵심 인자로 기존 항암 치료에서도 널리 활용돼 온 표적이다. DLL4는 혈관이 제대로 자라고 기능하도록 조절하는 신호 경로에 관여한다. ABL001이 이 두 경로를 동시에 차단함으로써 단일 표적 치료제 대비 강력하고 지속적인 혈관신생 억제 효과를 낼 것이라는 게 회사 측 기대다. 앞서 에이비엘바이오는 2018년 한국을 제외한 ABL001의 전 세계 권리를 트리거 테라퓨틱스에 이전했다. 계약 규모는 항암 분야 4억1000만달러, 안구질환 분야 1억8500만달러다. 이후 트리거 테라퓨틱스는 컴퍼스에 흡수 합병됐다. 현재 ABL001은 컴퍼스를 중심으로 미국에서 담도암 대상 임상 2/3상, 바이오마커 기반 고형암 바스켓 임상 2상을 진행 중이다. 이와 별도로 미국 MD 앤더슨 암센터에서는 담도암 환자를 대상으로 한 연구자 주도 임상(IST) 1/2상이 병행되고 있다. 컴퍼스가 2021년 중국 엘피사이언스 바이오파마에 중국, 홍콩·마카오·대만 지역에서 ABL001 권리에 대한 재실시권을 부여하는 기술수출 계약을 맺은 데 따라 중국에서는 엘피사이언스가 대장암을 적응증으로 임상 1/2상을 수행했다. 국내의 경우 한독에 기술수출돼 담도암 대상 임상 2상을 마무리한 상태다. 지난해 컴퍼스가 발표한 담도암 대상 미국 임상 2/3상(연구명 COMPANION-002) 핵심 톱라인 결과를 보면 ABL001·파클리탁셀 병용요법은 1차 평가지표인 객관적 반응률(ORR)을 충족하며 통계적 유의성을 확보했다. 토베시미그와 파클리탁셀을 병용 투여한 환자군의 ORR은 17.1%로 기존 담도암 2차 표준 치료 요법(4.9%)과 파클리탁셀 단독 투여군(5.3%) 대비 3배 이상 높은 수치를 보였다. 종양의 성장이 멈추거나 크기가 줄어든 상태를 나타내는 질병 통제율(DCR)은 61.2%를 기록, 종양 조절 능력을 입증했다. 또 임상 진행 과정에서 병용요법군의 사망 사례가 임상 설계 당시 예상보다 적게 발생해 전체 생존기간(OS) 개선 가능성에 대한 긍정적인 신호도 확인됐다. OS는 환자가 치료 시작 후 사망에 이르기까지 기간으로 FDA 승인 심사에서 중요하게 평가되는 기준으로 꼽힌다. 컴퍼스가 올해 1분기 내 OS와 무진행 생존기간(PFS) 등 핵심 지표에 대한 유의미한 데이터를 확보하게 되면 FDA 허가 절차에도 한층 탄력이 붙을 전망이다. 특히 ABL001은 지난 2024년 FDA로부터 패스트트랙(Fast Track) 지정을 받은 상태로 가속승인 절차를 밟아 상용화 시점을 대폭 앞당길 수 있을 것으로 예상된다. 가속승인은 미충족 의료 수요가 높은 중증 질환 치료제에 대해 임상 2상 혹은 3상 중간 데이터만으로도 우선 허가를 내주는 제도다. ABL001 허가가 이뤄질 경우 에이비엘바이오 입장에서는 설립 이후 첫 로열티가 발생하는 신약이 탄생하게 된다. 이는 단순히 기술수출을 통해 기술료를 받는 단계를 넘어 제품 판매에 따른 로열티 수익으로 영구적인 현금흐름을 창출하는 '지속 가능한 바이오텍'으로 도약했다는 점에서 의미가 크다는 평가다. 에이비엘바이오의 다른 파이프라인에서도 주목할 만하다. 회사는 최근 나스닥 상장사 노바브릿지바이오사이언스(전 아이맵)과 공동 개발 중인 이중항체 후보물질 'ABL111'의 임상 1b상 용량 확장 코호트에서 긍정적인 항암 효능을 확인했다고 발표했다. ABL111은 위암과 췌장암에서 과발현하는 클라우딘18.2을 표적하는 동시에 면역세포를 활성화를 유도하는 4-1BB에 동시에 결합하는 이중항체다. 에이비엘바이오의 그랩바디-T가 접목된 후보물질이다. 이번에 발표한 데이터는 용량 증량 코호트와 용량 확장 코호트에서 ABL111 8mg/kg 또는 12mg/kg 용량을 투여 받은 환자를 통합 분석한 결과다. 분석 결과 객관적 반응률(ORR)은 8mg/kg에서 77%(20/26), 12mg/kg에서 73%(19/26)로 나타났다. ABL111 병용요법은 환자의 PD-L1 및 클라우딘18.2 발현 수준과 관계없이 일관된 반응이 관찰됐으며, 안전성 프로파일 역시 현재 1차 치료 표준요법과 유사해 전반적으로 양호한 내약성을 보였다. 중앙 무진행생존기간(PFS)은 8mg/kg 용량에서 16.9개월로 확인됐으며, 12mg/kg 용량군은 추적 관찰 기간이 상대적으로 짧아 추후 공개될 예정이다. 양사는 ABL111 임상 1b상 전체 데이터를 올해 글로벌 학술대회에서 발표할 계획이다. 에이비엘바이오와 노바브릿지는 올 1분기 내 ABL111 8mg/kg와 12mg/kg 두 용량을 기존 표준 치료요법과 비교해 평가하는 글로벌 무작위 임상 2상을 개시한다는 목표다. 에이비엘바이오의 추가 기술수출 가능성 역시 올해 주요 관전 포인트다. 에이비엘바이오는 작년에만 8조원에 달하는 기술수출 성과를 냈다. 에이비엘바이오는 지난해 4월 글락소스미스클라인(GSK)에 퇴행성뇌질환 치료제 개발을 위한 뇌혈관장벽(BBB) 셔틀 플랫폼 '그랩바디-B'를 총 21억4010만파운드(4조1104억원) 규모로 이전한 데 이어 같은 해 11월 미국 일라이 릴리와 최대 26억200만달러(3조8236억원) 규모 그랩바디 플랫폼 기술수출과 공동 연구 계약을 맺었다. 리가켐바이오, LCB14 중국 상업화 가시권…LCB84 옵션·ADC 후속 모멘텀 리가켐바이오사이언스도 올해 다수 R&D 성과가 기대된다. 가장 주목받는 파이프라인은 사람상피세포성장인자수용체2형(HER2) 타깃 항체약물접합체(ADC) 후보물질 'LCB14'다. LCB14는 리가켐바이오가 중국 포순제약과 영국 익수다테라퓨틱스에 각각 기술수출한 파이프라인이다. 중국에서는 유방암 환자 대상 임상 1상과 로슈의 케사일라 비교 임상 3상이 진행 중이다. 그외 지역에서는 익수다를 통해 호주·미국·싱가포르·뉴질랜드 등에서 임상 1상이 진행되고 있다. LCB14는 글로벌 블록버스터 ADC인 엔허투 치료 이후 내성·불응 환자를 겨냥해 개발된 후보물질로 기존 HER2 ADC의 한계로 지적돼 온 내성 극복 가능성에 초점을 맞추고 있다. 임상 1a상 결과 엔허투 불응 환자 4명 중 3명에서 부분관해(PR)가 확인되며 내성 극복 가능성을 입증했다. LCB14가 올 상반기 공개될 임상 1b상 중간 결과에서 효능과 안전성을 입증할 경우 향후 글로벌 개발 전략과 추가 기술수출 가능성에 대한 논의가 본격화될 수 있다는 관측이 나온다. 중국 시장에서 임상 진척과 허가 전략 가시화 여부도 가치 재평가의 분기점이 될 것으로 보인다. 포순제약은 LCB14 유방암 임상 3상을 마무리하고 연내 중국 내 품목허가 신청(BLA)을 추진, 2027년 상업화를 본격화한다는 목표다. LCB14가 품목허가를 받게 되면 리가켐바이오도 설립 이후 처음으로 상용화 단계에 진입한 파이프라인을 보유하게 된다. 리가켐바이오의 비소세포폐암 후보물질 'LCB84'도 2026년을 기점으로 임상 개발 방향이 구체화될 전망이다. LCB84는 TROP2 항원을 타깃으로 하는 항체약물접합체(ADC) 파이프라인이다. 리가켐바이오는 2023년 12월 LCB84를 존슨앤드존슨에 역대 최대 규모인 17억달러(2조2600억원)에 기술수출했다. 리가켐바이오는 전이성 고형암 대상 단독·면역항암제 병용요법으로 LCB84 미국 임상 1상을 진행하고 있다. 리가켐바이오와 존슨앤드존슨이 맺은 기술수출 계약에는 단독개발 옵션 행사금 조항이 있다. 존슨앤드존슨이 미국 1/2상 임상 도중 단독개발 옵션을 행사하면 추가로 2억달러(2608억원)를 지급하는 조건이다. 올해 진입이 예상되는 임상 2상에서 존슨앤드존슨이 단독개발 옵션을 행사할 시 리가켐바이오는 해당 기술료를 수령하게 된다. 리가켐바이오가 미국 파트너사 넥스트큐어와 공동 개발 중인 ADC 후보물질 'LNCB74' 다국가 임상 1상 초기 유효성 입증 데이터(PoC)도 올 상반기 공개 예정이다. LNCB74는 유방암과 난소암·자궁내막암 등 부인암을 포함한 다양한 고형암에서 과발현되는 B7-H4 단백질을 표적한다. 현재 임상 1상 파트 1(용량 증량) 단계에서 안전성·내약성 평가를 진행 중이다. 최근 고용량 코호트 추가에 대한 FDA 승인을 획득하며 최대 허용 용량(MTD) 탐색과 초기 항암 효능 확인을 위한 환자 투여가 확대됐다. 디앤디파마텍·에이프릴바이오 임상 속도…티슈진, 인보사 재기 총력 디앤디파마텍과 에이프릴바이오, 올릭스 등도 글로벌 파트너사와 진행 중인 기술수출 파이프라인의 임상 결과 발표를 앞뒀다. 글루카곤 유사 펩타이드(GLP-1) 계열 비만 치료제를 개발 중인 디앤디파마텍의 R&D 성과에도 관심이 쏠린다. 이 회사는 기술수출 파트너사 멧세라가 미국 화이자로부터 인수되면서 업계의 주목을 받았다. 디앤디파마텍은 현재 ▲파킨슨병 및 알츠하이머병 치료제 'NLY01' ▲비만·대사이상 지방간염(MASH) 치료제 'DD01' ▲GLP-1 계열 경구형 펩타이드 비만 치료제 'DD02S' 등을 주요 파이프라인으로 보유 중이다. 이들 가운데 DD01은 미국에서 진행 중인 MASH 임상 2상에서 전체 환자 대상 48주 투약을 완료하며 허가 요건 검증 단계에 진입했다. 디앤디파마텍은 2024년 8월 DD01 첫 환자 투약 이후 현재까지 계획된 모든 일정을 차질 없이 소화했으며 이르면 오는 5월 FDA MASH 허가요건의 핵심인 간 조직생검 결과를 포함한 48주 탑라인(주요지표) 결과를 공개할 예정이다. 앞서 디앤디파마텍은 지난해 6월 발표한 12주차 1차 평가지표 결과에서 긍정적인 유효성을 입증한 바 있다. DD01 투약군은 12주 만에 지방간 30% 이상 감소 환자 비율 75.8%, 평균 지방간 감소율 62.3%를 기록하여 글로벌 경쟁사들의 장기간(24~72주) 투약 대비 경쟁력 있는 지방간 감소 효과를 확인했다. 또 하위 그룹 분석 결과를 통해 12주까지 투약을 모두 마친 환자를 대상으로 긍정적인 30% 이상 지방간 감소 환자비율 (85.7%)과 평균 지방간 감소율 (67.3%) 결과를 확인했다. 에이프릴바이오의 경우 올 1분기 자가면역질환 신약후보물질 'APB-R3' 임상 2a상 결과를 발표할 것으로 예상된다. 앞서 에이프릴바이오는 지난 2024년 6월 에보뮨과 APB-R3 관련 기술수출 계약을 체결했다. 반환 의무가 없는 선급금(업프론트) 1500만 달러를 포함해 최대 4억7500만 달러(약 6550억원) 규모 계약이다. APB-R3은 염증 반응을 일으키는 신호물질인 IL-18을 선택적으로 차단해 면역 과잉반응을 억제하는 방식의 단백질 치료제다. 에이프릴바이오의 자체 개발 플랫폼 SAFA((Serum Albumin Fab-Associated)를 적용해 약물이 혈청 알부민과 결합하도록 설계함으로써 체내에서 오랜 시간 안정적으로 작용하도록 만든 게 특징이다. 에보뮨은 이를 자사 파이프라인명 EVO301으로 명명, 아토피피부염(AD) 대상 임상 2상을 진행 중이다. 에보뮨은 향후 EVO301 적응증을 궤양성 대장염(UC), 크론병 등으로도 확장, 개발 범위를 넓혀갈 계획이다. 이와 함께 에이프릴바이오가 룬드벡에 이전한 자가면역질환 치료제 후보물질 'APB-A1' 임상 1상 결과도 올해 공개될 전망이다. APB-A1은 에이프릴바이오의 지속형 단백질 플랫폼(SAFA)에 항CD40L 항체 절편을 결합한 CD40 리간드(CD40L) 억제제다. 룬드벡은 2021년 10월 APB-A1에 대해 총 4억4800만 달러 규모 기술이전 계약을 체결하며 글로벌 개발 권리를 확보했다. 이후 룬드벡은 2022년 3월부터 8월까지 최초 인체 투여(First-in-Human) 임상을 완료, 2024년 9월 TED 임상 1b상을 개시했다. 올릭스의 경우 일라이릴리에 이전한 MASH와 비만 치료제 후보물질 'OLX75016(OLX702A)' 임상 진척을 계기로 추가 기술수출 가능성이 가시화될 수 있을지 주목된다. OLX75016은 RNA 간섭 기술 가운데 짧은 이중 가닥 RNA 유전물질(siRNA) 기술에 기반한 MASH와 비만 치료제 후보물질이다. OLX702A는 3개월에 1회 투여하는 피하주사 제형 비만 치료제로 개발되고 있다. 앞서 올릭스는 지난해 2월 OLX702A를 일라이릴리에 총 6억3000만달러(약 9117억원) 규모로 이전했다. 계약에는 MASH 발병에 관여하는 유전자 'MARC1'를 포함해 복수 유전자를 동시에 표적하는 멀티 타깃 치료제에 대해 릴리가 우선 검토권을 갖는 조항이 포함돼 있어 향후 추가 후보물질 도출 시 대규모 후속 계약으로 확대될 여지도 남아 있다. 코오롱그룹의 바이오 자회사 코오롱티슈진도 올해 핵심 파이프라인의 임상 결과를 통해 상업화 가능성을 검증받게 된다. 회사는 세계 최초 골관절염 유전자치료제 'TG-C'(구 인보사) 미국 임상 3상을 진행 중으로 올해 두 건의 임상 3상 톱라인 결과를 연속으로 발표할 예정이다. 회사는 첫 번째 임상 3상을 3월에 종료한 뒤 7월 결과를 발표하고 두 번째 임상 3상은 7월 종료 후 10월 톱라인 공개를 목표로 하고 있다. TG-C는 코오롱그룹 계열사 코오롱생명과학이 2017년 허가를 받은 세계 최초 골관절염 유전자치료제다. 아시아 판권은 코오롱생명과학이, 미국·유럽 등 글로벌 판권은 코오롱티슈진이 보유 중이다. 2019년 성분 변경 논란으로 국내 허가는 취소됐지만 미국에서는 2020년 FDA가 임상 재개를 허용하면서 글로벌 재기의 가능성을 이어가고 있다. 국내 재출시 가능성은 사라졌지만 세계 최대 의약품 시장인 미국 출시에 성공한다면 더 큰 반전의 계기를 마련할 수 있다는 평가다.2026-01-08 06:00:59차지현 기자
다가오는 검증의 시간...K-바이오, 글로벌 경쟁력 시험대[데일리팜=차지현 기자] 올해 글로벌 시장에서 국내 바이오벤처의 연구개발(R&D) 성과가 본격 시험대에 오른다. 에이비엘바이오는 설립 이후 처음으로 기술수출 파이프라인이 상업화 가능성을 검증받는 단계에 진입했다. 리가켐바이오와 디앤디파마텍, 에이프릴바이오 등도 글로벌 파트너사와 함께 주요 기술수출 자산의 임상 데이터를 잇따라 공개할 예정이다. 코오롱티슈진은 오는 6월 핵심 파이프라인의 임상 3상 결과 공개를 앞뒀다. ABL바이오, 첫 로열티 신약 눈앞…ABL001 2/3상 최종 데이터 공개 예정 8일 바이오 업계에 따르면 올 1분기 에이비엘바이오는 파트너사 미국 컴퍼스 테라퓨틱스를 통해 담도암 치료제 후보물질 'ABL001'(CTX-009·성분명 토베시미그)의 임상 2/3상 최종 결과를 발표할 예정이다. 컴퍼스는 해당 데이터를 바탕으로 올 하반기께 미국 식품의약국(FDA)에 생물의약품허가(BLA) 신청 절차에 착수할 것으로 점쳐진다. ABL001은 신생혈관 형성에 관여하는 혈관내피성장인자(VEGF)와 델타 유사 리간드 4(DLL4)를 동시에 억제하는 이중항체 기반 바이오 신약이다.VEGF는 종양이 성장하는 데 필요한 혈관을 새로 만드는 핵심 인자로 기존 항암 치료에서도 널리 활용돼 온 표적이다. DLL4는 혈관이 제대로 자라고 기능하도록 조절하는 신호 경로에 관여한다. ABL001이 이 두 경로를 동시에 차단함으로써 단일 표적 치료제 대비 강력하고 지속적인 혈관신생 억제 효과를 낼 것이라는 게 회사 측 기대다. 앞서 에이비엘바이오는 2018년 한국을 제외한 ABL001의 전 세계 권리를 트리거 테라퓨틱스에 이전했다. 계약 규모는 항암 분야 4억1000만달러, 안구질환 분야 1억8500만달러다. 이후 트리거 테라퓨틱스는 컴퍼스에 흡수 합병됐다. 현재 ABL001은 컴퍼스를 중심으로 미국에서 담도암 대상 임상 2/3상, 바이오마커 기반 고형암 바스켓 임상 2상을 진행 중이다. 이와 별도로 미국 MD 앤더슨 암센터에서는 담도암 환자를 대상으로 한 연구자 주도 임상(IST) 1/2상이 병행되고 있다. 컴퍼스가 2021년 중국 엘피사이언스 바이오파마에 중국, 홍콩·마카오·대만 지역에서 ABL001 권리에 대한 재실시권을 부여하는 기술수출 계약을 맺은 데 따라 중국에서는 엘피사이언스가 대장암을 적응증으로 임상 1/2상을 수행했다. 국내의 경우 한독에 기술수출돼 담도암 대상 임상 2상을 마무리한 상태다. 지난해 컴퍼스가 발표한 담도암 대상 미국 임상 2/3상(연구명 COMPANION-002) 핵심 톱라인 결과를 보면 ABL001·파클리탁셀 병용요법은 1차 평가지표인 객관적 반응률(ORR)을 충족하며 통계적 유의성을 확보했다. 토베시미그와 파클리탁셀을 병용 투여한 환자군의 ORR은 17.1%로 기존 담도암 2차 표준 치료 요법(4.9%)과 파클리탁셀 단독 투여군(5.3%) 대비 3배 이상 높은 수치를 보였다. 종양의 성장이 멈추거나 크기가 줄어든 상태를 나타내는 질병 통제율(DCR)은 61.2%를 기록, 종양 조절 능력을 입증했다. 또 임상 진행 과정에서 병용요법군의 사망 사례가 임상 설계 당시 예상보다 적게 발생해 전체 생존기간(OS) 개선 가능성에 대한 긍정적인 신호도 확인됐다. OS는 환자가 치료 시작 후 사망에 이르기까지 기간으로 FDA 승인 심사에서 중요하게 평가되는 기준으로 꼽힌다. 컴퍼스가 올해 1분기 내 OS와 무진행 생존기간(PFS) 등 핵심 지표에 대한 유의미한 데이터를 확보하게 되면 FDA 허가 절차에도 한층 탄력이 붙을 전망이다. 특히 ABL001은 지난 2024년 FDA로부터 패스트트랙(Fast Track) 지정을 받은 상태로 가속승인 절차를 밟아 상용화 시점을 대폭 앞당길 수 있을 것으로 예상된다. 가속승인은 미충족 의료 수요가 높은 중증 질환 치료제에 대해 임상 2상 혹은 3상 중간 데이터만으로도 우선 허가를 내주는 제도다. ABL001 허가가 이뤄질 경우 에이비엘바이오 입장에서는 설립 이후 첫 로열티가 발생하는 신약이 탄생하게 된다. 이는 단순히 기술수출을 통해 기술료를 받는 단계를 넘어 제품 판매에 따른 로열티 수익으로 영구적인 현금흐름을 창출하는 '지속 가능한 바이오텍'으로 도약했다는 점에서 의미가 크다는 평가다. 에이비엘바이오의 다른 파이프라인에서도 주목할 만하다. 회사는 최근 나스닥 상장사 노바브릿지바이오사이언스(전 아이맵)과 공동 개발 중인 이중항체 후보물질 'ABL111'의 임상 1b상 용량 확장 코호트에서 긍정적인 항암 효능을 확인했다고 발표했다. ABL111은 위암과 췌장암에서 과발현하는 클라우딘18.2을 표적하는 동시에 면역세포를 활성화를 유도하는 4-1BB에 동시에 결합하는 이중항체다. 에이비엘바이오의 그랩바디-T가 접목된 후보물질이다. 이번에 발표한 데이터는 용량 증량 코호트와 용량 확장 코호트에서 ABL111 8mg/kg 또는 12mg/kg 용량을 투여 받은 환자를 통합 분석한 결과다. 분석 결과 객관적 반응률(ORR)은 8mg/kg에서 77%(20/26), 12mg/kg에서 73%(19/26)로 나타났다. ABL111 병용요법은 환자의 PD-L1 및 클라우딘18.2 발현 수준과 관계없이 일관된 반응이 관찰됐으며, 안전성 프로파일 역시 현재 1차 치료 표준요법과 유사해 전반적으로 양호한 내약성을 보였다. 중앙 무진행생존기간(PFS)은 8mg/kg 용량에서 16.9개월로 확인됐으며, 12mg/kg 용량군은 추적 관찰 기간이 상대적으로 짧아 추후 공개될 예정이다. 양사는 ABL111 임상 1b상 전체 데이터를 올해 글로벌 학술대회에서 발표할 계획이다. 에이비엘바이오와 노바브릿지는 올 1분기 내 ABL111 8mg/kg와 12mg/kg 두 용량을 기존 표준 치료요법과 비교해 평가하는 글로벌 무작위 임상 2상을 개시한다는 목표다. 에이비엘바이오의 추가 기술수출 가능성 역시 올해 주요 관전 포인트다. 에이비엘바이오는 작년에만 8조원에 달하는 기술수출 성과를 냈다. 에이비엘바이오는 지난해 4월 글락소스미스클라인(GSK)에 퇴행성뇌질환 치료제 개발을 위한 뇌혈관장벽(BBB) 셔틀 플랫폼 '그랩바디-B'를 총 21억4010만파운드(4조1104억원) 규모로 이전한 데 이어 같은 해 11월 미국 일라이 릴리와 최대 26억200만달러(3조8236억원) 규모 그랩바디 플랫폼 기술수출과 공동 연구 계약을 맺었다. 리가켐바이오, LCB14 중국 상업화 가시권…LCB84 옵션·ADC 후속 모멘텀 리가켐바이오사이언스도 올해 다수 R&D 성과가 기대된다. 가장 주목받는 파이프라인은 사람상피세포성장인자수용체2형(HER2) 타깃 항체약물접합체(ADC) 후보물질 'LCB14'다. LCB14는 리가켐바이오가 중국 포순제약과 영국 익수다테라퓨틱스에 각각 기술수출한 파이프라인이다. 중국에서는 유방암 환자 대상 임상 1상과 로슈의 케사일라 비교 임상 3상이 진행 중이다. 그외 지역에서는 익수다를 통해 호주·미국·싱가포르·뉴질랜드 등에서 임상 1상이 진행되고 있다. LCB14는 글로벌 블록버스터 ADC인 엔허투 치료 이후 내성·불응 환자를 겨냥해 개발된 후보물질로 기존 HER2 ADC의 한계로 지적돼 온 내성 극복 가능성에 초점을 맞추고 있다. 임상 1a상 결과 엔허투 불응 환자 4명 중 3명에서 부분관해(PR)가 확인되며 내성 극복 가능성을 입증했다. LCB14가 올 상반기 공개될 임상 1b상 중간 결과에서 효능과 안전성을 입증할 경우 향후 글로벌 개발 전략과 추가 기술수출 가능성에 대한 논의가 본격화될 수 있다는 관측이 나온다. 중국 시장에서 임상 진척과 허가 전략 가시화 여부도 가치 재평가의 분기점이 될 것으로 보인다. 포순제약은 LCB14 유방암 임상 3상을 마무리하고 연내 중국 내 품목허가 신청(BLA)을 추진, 2027년 상업화를 본격화한다는 목표다. LCB14가 품목허가를 받게 되면 리가켐바이오도 설립 이후 처음으로 상용화 단계에 진입한 파이프라인을 보유하게 된다. 리가켐바이오의 비소세포폐암 후보물질 'LCB84'도 2026년을 기점으로 임상 개발 방향이 구체화될 전망이다. LCB84는 TROP2 항원을 타깃으로 하는 항체약물접합체(ADC) 파이프라인이다. 리가켐바이오는 2023년 12월 LCB84를 존슨앤드존슨에 역대 최대 규모인 17억달러(2조2600억원)에 기술수출했다. 리가켐바이오는 전이성 고형암 대상 단독·면역항암제 병용요법으로 LCB84 미국 임상 1상을 진행하고 있다. 리가켐바이오와 존슨앤드존슨이 맺은 기술수출 계약에는 단독개발 옵션 행사금 조항이 있다. 존슨앤드존슨이 미국 1/2상 임상 도중 단독개발 옵션을 행사하면 추가로 2억달러(2608억원)를 지급하는 조건이다. 올해 진입이 예상되는 임상 2상에서 존슨앤드존슨이 단독개발 옵션을 행사할 시 리가켐바이오는 해당 기술료를 수령하게 된다. 리가켐바이오가 미국 파트너사 넥스트큐어와 공동 개발 중인 ADC 후보물질 'LNCB74' 다국가 임상 1상 초기 유효성 입증 데이터(PoC)도 올 상반기 공개 예정이다. LNCB74는 유방암과 난소암·자궁내막암 등 부인암을 포함한 다양한 고형암에서 과발현되는 B7-H4 단백질을 표적한다. 현재 임상 1상 파트 1(용량 증량) 단계에서 안전성·내약성 평가를 진행 중이다. 최근 고용량 코호트 추가에 대한 FDA 승인을 획득하며 최대 허용 용량(MTD) 탐색과 초기 항암 효능 확인을 위한 환자 투여가 확대됐다. 디앤디파마텍·에이프릴바이오 임상 속도…티슈진, 인보사 재기 총력 디앤디파마텍과 에이프릴바이오, 올릭스 등도 글로벌 파트너사와 진행 중인 기술수출 파이프라인의 임상 결과 발표를 앞뒀다. 글루카곤 유사 펩타이드(GLP-1) 계열 비만 치료제를 개발 중인 디앤디파마텍의 R&D 성과에도 관심이 쏠린다. 이 회사는 기술수출 파트너사 멧세라가 미국 화이자로부터 인수되면서 업계의 주목을 받았다. 디앤디파마텍은 현재 ▲파킨슨병 및 알츠하이머병 치료제 'NLY01' ▲비만·대사이상 지방간염(MASH) 치료제 'DD01' ▲GLP-1 계열 경구형 펩타이드 비만 치료제 'DD02S' 등을 주요 파이프라인으로 보유 중이다. 이들 가운데 DD01은 미국에서 진행 중인 MASH 임상 2상에서 전체 환자 대상 48주 투약을 완료하며 허가 요건 검증 단계에 진입했다. 디앤디파마텍은 2024년 8월 DD01 첫 환자 투약 이후 현재까지 계획된 모든 일정을 차질 없이 소화했으며 이르면 오는 5월 FDA MASH 허가요건의 핵심인 간 조직생검 결과를 포함한 48주 탑라인(주요지표) 결과를 공개할 예정이다. 앞서 디앤디파마텍은 지난해 6월 발표한 12주차 1차 평가지표 결과에서 긍정적인 유효성을 입증한 바 있다. DD01 투약군은 12주 만에 지방간 30% 이상 감소 환자 비율 75.8%, 평균 지방간 감소율 62.3%를 기록하여 글로벌 경쟁사들의 장기간(24~72주) 투약 대비 경쟁력 있는 지방간 감소 효과를 확인했다. 또 하위 그룹 분석 결과를 통해 12주까지 투약을 모두 마친 환자를 대상으로 긍정적인 30% 이상 지방간 감소 환자비율 (85.7%)과 평균 지방간 감소율 (67.3%) 결과를 확인했다. 에이프릴바이오의 경우 올 1분기 자가면역질환 신약후보물질 'APB-R3' 임상 2a상 결과를 발표할 것으로 예상된다. 앞서 에이프릴바이오는 지난 2024년 6월 에보뮨과 APB-R3 관련 기술수출 계약을 체결했다. 반환 의무가 없는 선급금(업프론트) 1500만 달러를 포함해 최대 4억7500만 달러(약 6550억원) 규모 계약이다. APB-R3은 염증 반응을 일으키는 신호물질인 IL-18을 선택적으로 차단해 면역 과잉반응을 억제하는 방식의 단백질 치료제다. 에이프릴바이오의 자체 개발 플랫폼 SAFA((Serum Albumin Fab-Associated)를 적용해 약물이 혈청 알부민과 결합하도록 설계함으로써 체내에서 오랜 시간 안정적으로 작용하도록 만든 게 특징이다. 에보뮨은 이를 자사 파이프라인명 EVO301으로 명명, 아토피피부염(AD) 대상 임상 2상을 진행 중이다. 에보뮨은 향후 EVO301 적응증을 궤양성 대장염(UC), 크론병 등으로도 확장, 개발 범위를 넓혀갈 계획이다. 이와 함께 에이프릴바이오가 룬드벡에 이전한 자가면역질환 치료제 후보물질 'APB-A1' 임상 1상 결과도 올해 공개될 전망이다. APB-A1은 에이프릴바이오의 지속형 단백질 플랫폼(SAFA)에 항CD40L 항체 절편을 결합한 CD40 리간드(CD40L) 억제제다. 룬드벡은 2021년 10월 APB-A1에 대해 총 4억4800만 달러 규모 기술이전 계약을 체결하며 글로벌 개발 권리를 확보했다. 이후 룬드벡은 2022년 3월부터 8월까지 최초 인체 투여(First-in-Human) 임상을 완료, 2024년 9월 TED 임상 1b상을 개시했다. 올릭스의 경우 일라이릴리에 이전한 MASH와 비만 치료제 후보물질 'OLX75016(OLX702A)' 임상 진척을 계기로 추가 기술수출 가능성이 가시화될 수 있을지 주목된다. OLX75016은 RNA 간섭 기술 가운데 짧은 이중 가닥 RNA 유전물질(siRNA) 기술에 기반한 MASH와 비만 치료제 후보물질이다. OLX702A는 3개월에 1회 투여하는 피하주사 제형 비만 치료제로 개발되고 있다. 앞서 올릭스는 지난해 2월 OLX702A를 일라이릴리에 총 6억3000만달러(약 9117억원) 규모로 이전했다. 계약에는 MASH 발병에 관여하는 유전자 'MARC1'를 포함해 복수 유전자를 동시에 표적하는 멀티 타깃 치료제에 대해 릴리가 우선 검토권을 갖는 조항이 포함돼 있어 향후 추가 후보물질 도출 시 대규모 후속 계약으로 확대될 여지도 남아 있다. 코오롱그룹의 바이오 자회사 코오롱티슈진도 올해 핵심 파이프라인의 임상 결과를 통해 상업화 가능성을 검증받게 된다. 회사는 세계 최초 골관절염 유전자치료제 'TG-C'(구 인보사) 미국 임상 3상을 진행 중으로 올해 두 건의 임상 3상 톱라인 결과를 연속으로 발표할 예정이다. 회사는 첫 번째 임상 3상을 3월에 종료한 뒤 7월 결과를 발표하고 두 번째 임상 3상은 7월 종료 후 10월 톱라인 공개를 목표로 하고 있다. TG-C는 코오롱그룹 계열사 코오롱생명과학이 2017년 허가를 받은 세계 최초 골관절염 유전자치료제다. 아시아 판권은 코오롱생명과학이, 미국·유럽 등 글로벌 판권은 코오롱티슈진이 보유 중이다. 2019년 성분 변경 논란으로 국내 허가는 취소됐지만 미국에서는 2020년 FDA가 임상 재개를 허용하면서 글로벌 재기의 가능성을 이어가고 있다. 국내 재출시 가능성은 사라졌지만 세계 최대 의약품 시장인 미국 출시에 성공한다면 더 큰 반전의 계기를 마련할 수 있다는 평가다.2026-01-08 06:00:59차지현 기자 -
 제약사 제품설명회 의료인 제공 펜·노트에 제품명 표기 불가[데일리팜=천승현 기자] 제약사가 제품설명회에서 보건의료전문가에 제공하는 펜과 노트 판촉물에 회사명만 기재가 가능하고 제품명 표기는 금지된다. 7일 업계에 따르면 한국제약바이오협회는 이 같은 내용을 담은 ‘의약품 거래에 관한 공정경쟁규약’과 ‘공정경쟁규약 세부 운용기준’ 5차 개정이 공정거래위원회 승인을 받았다. 이번에 신설된 내용 중 의료전문가에 제공되는 판촉물 범위가 구체적으로 제한됐다. 기존에는 개별 요양기관을 방문해 자사 의약품을 설명하는 제품설명회에서 제약사는 보건의료전문가에게 식음료 및 자사의 회사명 또는 제품명이 기입된 소액의 판촉물을 제공할 수 있도록 허용했다. 개정 내용에서는 현장에서 의약학적 정보 전달을 위해 회사명이 기입된 펜과 노트를 제공할 수 있도록 규정했다. 다만 이 경우 제품명의 표기는 금지된다는 내용이 신설됐다. 추가로 기념품을 제공해서도 안되며 제공되는 펜과 노트의 합산가액도 약사법 시행규칙 허용되는 경제적 이익 등의 범위에 명시된 ‘5만원 이하의 기념품’의 범위에 따라야 한다. 개정 규약에서는 제약사는 회계연도 종료 후 3개월 이내에 약사·한약사·의료인·의료기관 개설자 또는 의료기관 종사자에게 경제적 이익 등 내역에 관한 지출보고서를 작성해 공개하고 해당 지출보고서와 관련 장부, 근거 자료를 5년간 보관해야 한다는 내용이 신설됐다. 의약품 판촉영업자에 약사법에 규정된 의약품공급자(의약품 품목허가를 받은 자, 수입자 또는 의약품 도매상) 뿐만 아니라 ‘의약품 판매촉진 업무를 위탁받은 자 및 이들로부터 재위탁을 받은 자’도 새롭게 포함됐다. 제약사나 도매업체로부터 영업 대행을 위탁받은 CSO 업체들도 공정거래규약의 판촉 업무 규제를 받을 수 있다는 내용이 구체화됐다. 제약기업 등이 국내 학술대회, 국내 개최 국제학술대회를 지원하는 경우 해당 학술대회와 관련해 추가적으로 기부, 식음료 제공, 부스 임대, 광고 등의 금품류를 제공해서는 안된다는 내용도 새롭게 반영됐다. 불법 학술대회 지원 적발 업체에 대한 제재 내용도 신설됐다. 개정 규정에 따라 제약기업 등이 부정한 목적을 위해 학술대회 개최·운영을 지원했다는 사실이 법원 판결, 행정기관의 처분 또는 제약바이오협회의 조사 등을 통해 확인되는 경우 협회는 부정한 목적을 위해 개최운영을 지원한 사실 등이 확정된 날로부터 향후 2년간 해당 사업자의 학술대회 개최·운영 지원을 승인해서는 안된다.2026-01-07 12:04:16천승현 기자
제약사 제품설명회 의료인 제공 펜·노트에 제품명 표기 불가[데일리팜=천승현 기자] 제약사가 제품설명회에서 보건의료전문가에 제공하는 펜과 노트 판촉물에 회사명만 기재가 가능하고 제품명 표기는 금지된다. 7일 업계에 따르면 한국제약바이오협회는 이 같은 내용을 담은 ‘의약품 거래에 관한 공정경쟁규약’과 ‘공정경쟁규약 세부 운용기준’ 5차 개정이 공정거래위원회 승인을 받았다. 이번에 신설된 내용 중 의료전문가에 제공되는 판촉물 범위가 구체적으로 제한됐다. 기존에는 개별 요양기관을 방문해 자사 의약품을 설명하는 제품설명회에서 제약사는 보건의료전문가에게 식음료 및 자사의 회사명 또는 제품명이 기입된 소액의 판촉물을 제공할 수 있도록 허용했다. 개정 내용에서는 현장에서 의약학적 정보 전달을 위해 회사명이 기입된 펜과 노트를 제공할 수 있도록 규정했다. 다만 이 경우 제품명의 표기는 금지된다는 내용이 신설됐다. 추가로 기념품을 제공해서도 안되며 제공되는 펜과 노트의 합산가액도 약사법 시행규칙 허용되는 경제적 이익 등의 범위에 명시된 ‘5만원 이하의 기념품’의 범위에 따라야 한다. 개정 규약에서는 제약사는 회계연도 종료 후 3개월 이내에 약사·한약사·의료인·의료기관 개설자 또는 의료기관 종사자에게 경제적 이익 등 내역에 관한 지출보고서를 작성해 공개하고 해당 지출보고서와 관련 장부, 근거 자료를 5년간 보관해야 한다는 내용이 신설됐다. 의약품 판촉영업자에 약사법에 규정된 의약품공급자(의약품 품목허가를 받은 자, 수입자 또는 의약품 도매상) 뿐만 아니라 ‘의약품 판매촉진 업무를 위탁받은 자 및 이들로부터 재위탁을 받은 자’도 새롭게 포함됐다. 제약사나 도매업체로부터 영업 대행을 위탁받은 CSO 업체들도 공정거래규약의 판촉 업무 규제를 받을 수 있다는 내용이 구체화됐다. 제약기업 등이 국내 학술대회, 국내 개최 국제학술대회를 지원하는 경우 해당 학술대회와 관련해 추가적으로 기부, 식음료 제공, 부스 임대, 광고 등의 금품류를 제공해서는 안된다는 내용도 새롭게 반영됐다. 불법 학술대회 지원 적발 업체에 대한 제재 내용도 신설됐다. 개정 규정에 따라 제약기업 등이 부정한 목적을 위해 학술대회 개최·운영을 지원했다는 사실이 법원 판결, 행정기관의 처분 또는 제약바이오협회의 조사 등을 통해 확인되는 경우 협회는 부정한 목적을 위해 개최운영을 지원한 사실 등이 확정된 날로부터 향후 2년간 해당 사업자의 학술대회 개최·운영 지원을 승인해서는 안된다.2026-01-07 12:04:16천승현 기자 -
 글로벌제약, 신규기전 'ATR 억제제' 잇단 개발 난관[데일리팜=손형민 기자] 글로벌 제약업계가 차세대 항암 전략으로 주목해온 ATR 억제제 개발이 잇따른 임상 실패로 난항을 겪고 있다. 면역항암제 내성 극복을 목표로 한 합성치사(synthetic lethality) 접근이 아직까지 명확한 임상적 성과로 이어지지 못하면서 기전 자체에 대한 재평가 필요성도 제기되고 있다. 6일 관련 업계에 따르면 아스트라제네카는 최근 ATR 억제제 '세랄라서팁(ceralasertib)'과 PD-L1 열 면역항암제 '임핀지(더발루맙)' 병용요법을 평가한 임상 3상 LATIFY 연구에서 1차 평가지표를 충족하지 못했다고 밝혔다. ATR은 DNA 손상 반응 경로에서 핵심적인 역할을 하는 키나아제로 특정 유전자 결함을 가진 암세포의 생존 경로를 차단하는 합성치사 전략의 주요 타깃으로 주목받아 왔다. 해당 기전 약물들은 DNA 복구 경로를 교란해 암세포를 사멸시키는 기전을 갖고 있다. 이는 BRCA 변이 암종에서 성공을 거둔 PARP 억제제 특히 아스트라제네카의 '린파자(올라파립)' 개발로 부각된 개념이다. 다만 거듭된 임상 실패로 기전적 이점에 대해 의문점이 붙게 됐다. 아스트라제네카가 진행한 LATIFY 연구는 이전에 항 PD-L1 치료와 백금 기반 항암화학요법을 받은 이후 질병이 진행된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자 594명을 대상으로 진행됐다. 표적치료가 가능하지만, 유전체 변이가 없는 환자를 대상으로 세랄라서팁+임핀지 병용군과 표준 2차 치료인 도세탁셀 단독요법을 비교했다. 임상 결과, 전체생존기간(OS)에서 세랄라서팁+임핀지 병용요법은 도세탁셀 대비 통계적으로 유의한 개선을 보이지 못했다. 아스트라제네카는 병용요법의 내약성은 전반적으로 양호했다고 설명했으나, 이번 결과로 임상은 1차 평가변수 달성에는 실패했다. 회사 측은 추후 학술대회를 통해 상세 데이터를 공개할 예정이다. 세랄라서팁과 임핀지를 수술 후 보조요법으로 평가하는 또 다른 비소세포폐암 임상 3상(환자 수 630명)은 여전히 환자 모집이 진행 중이며, 결과는 2028년 도출될 예정이다. 아스트라제네카는 해당 연구와 고형암 대상 임상 2상 프로그램에 대해서는 별도의 업데이트를 내놓지 않았다. 수전 갤브레이스 아스트라제네카 종양·혈액학 R&D 총괄은 “LATIFY 연구는 기존 치료에 반응하지 않는 폐암 환자에서 ATR 억제와 면역항암제 병용을 통해 면역 반응을 다시 활성화하는 것을 목표로 했다”며 “결과는 아쉽지만, 폐암 환자의 치료 성과를 개선하기 위한 혁신 신약 개발에 대한 의지는 변함없다”고 밝혔다. 실패의 역사 겪었던 ATR 억제제...회생 가능성은 세랄라서팁의 이번 실패는 ATR 억제제 계열 전반의 개발 난항을 다시 한 번 부각시키는 계기가 됐다. 앞서 아스트라제네카는 흑색종 적응증에서 세랄라서팁 개발을 중단한 바 있으며, 바이엘의 '엘리무서팁(elimusertib)'은 2023년 개발이 중단됐다. 또 다른 ATR 억제제 후보물질인 '카몬서팁(camonsertib)'의 경우 로슈가 미국 리페어 테라퓨틱스(Repare Therapeutics)에 반환하며 최대 12억 달러 규모의 기술이전 계약이 사실상 종료됐다. 리페어는 개발을 이어가겠다는 입장이지만 최근 분기 업데이트에서는 해당 신약후보물질에 대한 언급을 하지 않았으며, 현재는 제노테라퓨틱스에 인수되는 절차를 밟고 있다. 머크의 '베르조서팁(berzosertib)' 역시 임상에 진입했지만 현재는 중단된 상태다. 머크는 토포테칸 병용요법을 통해 가능성을 다시 확인하고 있다. 환자들은 무작위로 토포테칸 단독요법군에 20명, 토포테칸+베르조세팁 40명을 투여하도록 선정됐다. 연구진은 치료 의도 인구에서 무진행생존기간(PFS)을 1차 평가변수로 설정됐고 2차 평가변수에는 OS가 포함됐다. 최근 발표된 임상 2상 무작위 연구에 따르면, 베르조서팁과 토포테칸 병용요법은 재발 소세포폐암 환자에서 토포테칸 단독요법 대비 OS를 유의하게 개선했으나 PFS 개선에는 실패했다. 해당 연구는 2019년 12월부터 2022년 12월까지 미국 내 16개 암 센터에서 진행됐으며, 이전에 백금 기반 항암화학요법을 받은 재발 환자 60명이 참여했다. 임상 결과, 중간 추적관찰 기간 21.3개월 시점에서 병용군과 단독군 간 PFS 차이는 유의하지 않았다. 자세히 살펴보면 베르조서팁과 토포테칸 병용요법군의 PFS는 3.0개월로, 대조군 3.9개월 대비 길지 않았다. 반면 OS는 병용요법군에서 8.9개월로, 단독요법군 5.4개월 대비 유의한 개선을 보였다. 중간 추적 관찰 기간이 21.3개월 후, 토포테칸 단독군과 토포테칸 및 베르조서팁 군 간 PFS는 각각 3.0개월과 3.9개월로 유의하게 나타나지 않았다. 다만 병용요법군의 OS는 8.9개월로, 토포테칸군 5.4개월 대비 개선됐다. 3~4등급 혈소판감소증과 모든 등급의 메스꺼움과 같은 부작용은 두 군 간에 유사하게 나타났다.2026-01-06 12:10:26손형민 기자
글로벌제약, 신규기전 'ATR 억제제' 잇단 개발 난관[데일리팜=손형민 기자] 글로벌 제약업계가 차세대 항암 전략으로 주목해온 ATR 억제제 개발이 잇따른 임상 실패로 난항을 겪고 있다. 면역항암제 내성 극복을 목표로 한 합성치사(synthetic lethality) 접근이 아직까지 명확한 임상적 성과로 이어지지 못하면서 기전 자체에 대한 재평가 필요성도 제기되고 있다. 6일 관련 업계에 따르면 아스트라제네카는 최근 ATR 억제제 '세랄라서팁(ceralasertib)'과 PD-L1 열 면역항암제 '임핀지(더발루맙)' 병용요법을 평가한 임상 3상 LATIFY 연구에서 1차 평가지표를 충족하지 못했다고 밝혔다. ATR은 DNA 손상 반응 경로에서 핵심적인 역할을 하는 키나아제로 특정 유전자 결함을 가진 암세포의 생존 경로를 차단하는 합성치사 전략의 주요 타깃으로 주목받아 왔다. 해당 기전 약물들은 DNA 복구 경로를 교란해 암세포를 사멸시키는 기전을 갖고 있다. 이는 BRCA 변이 암종에서 성공을 거둔 PARP 억제제 특히 아스트라제네카의 '린파자(올라파립)' 개발로 부각된 개념이다. 다만 거듭된 임상 실패로 기전적 이점에 대해 의문점이 붙게 됐다. 아스트라제네카가 진행한 LATIFY 연구는 이전에 항 PD-L1 치료와 백금 기반 항암화학요법을 받은 이후 질병이 진행된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자 594명을 대상으로 진행됐다. 표적치료가 가능하지만, 유전체 변이가 없는 환자를 대상으로 세랄라서팁+임핀지 병용군과 표준 2차 치료인 도세탁셀 단독요법을 비교했다. 임상 결과, 전체생존기간(OS)에서 세랄라서팁+임핀지 병용요법은 도세탁셀 대비 통계적으로 유의한 개선을 보이지 못했다. 아스트라제네카는 병용요법의 내약성은 전반적으로 양호했다고 설명했으나, 이번 결과로 임상은 1차 평가변수 달성에는 실패했다. 회사 측은 추후 학술대회를 통해 상세 데이터를 공개할 예정이다. 세랄라서팁과 임핀지를 수술 후 보조요법으로 평가하는 또 다른 비소세포폐암 임상 3상(환자 수 630명)은 여전히 환자 모집이 진행 중이며, 결과는 2028년 도출될 예정이다. 아스트라제네카는 해당 연구와 고형암 대상 임상 2상 프로그램에 대해서는 별도의 업데이트를 내놓지 않았다. 수전 갤브레이스 아스트라제네카 종양·혈액학 R&D 총괄은 “LATIFY 연구는 기존 치료에 반응하지 않는 폐암 환자에서 ATR 억제와 면역항암제 병용을 통해 면역 반응을 다시 활성화하는 것을 목표로 했다”며 “결과는 아쉽지만, 폐암 환자의 치료 성과를 개선하기 위한 혁신 신약 개발에 대한 의지는 변함없다”고 밝혔다. 실패의 역사 겪었던 ATR 억제제...회생 가능성은 세랄라서팁의 이번 실패는 ATR 억제제 계열 전반의 개발 난항을 다시 한 번 부각시키는 계기가 됐다. 앞서 아스트라제네카는 흑색종 적응증에서 세랄라서팁 개발을 중단한 바 있으며, 바이엘의 '엘리무서팁(elimusertib)'은 2023년 개발이 중단됐다. 또 다른 ATR 억제제 후보물질인 '카몬서팁(camonsertib)'의 경우 로슈가 미국 리페어 테라퓨틱스(Repare Therapeutics)에 반환하며 최대 12억 달러 규모의 기술이전 계약이 사실상 종료됐다. 리페어는 개발을 이어가겠다는 입장이지만 최근 분기 업데이트에서는 해당 신약후보물질에 대한 언급을 하지 않았으며, 현재는 제노테라퓨틱스에 인수되는 절차를 밟고 있다. 머크의 '베르조서팁(berzosertib)' 역시 임상에 진입했지만 현재는 중단된 상태다. 머크는 토포테칸 병용요법을 통해 가능성을 다시 확인하고 있다. 환자들은 무작위로 토포테칸 단독요법군에 20명, 토포테칸+베르조세팁 40명을 투여하도록 선정됐다. 연구진은 치료 의도 인구에서 무진행생존기간(PFS)을 1차 평가변수로 설정됐고 2차 평가변수에는 OS가 포함됐다. 최근 발표된 임상 2상 무작위 연구에 따르면, 베르조서팁과 토포테칸 병용요법은 재발 소세포폐암 환자에서 토포테칸 단독요법 대비 OS를 유의하게 개선했으나 PFS 개선에는 실패했다. 해당 연구는 2019년 12월부터 2022년 12월까지 미국 내 16개 암 센터에서 진행됐으며, 이전에 백금 기반 항암화학요법을 받은 재발 환자 60명이 참여했다. 임상 결과, 중간 추적관찰 기간 21.3개월 시점에서 병용군과 단독군 간 PFS 차이는 유의하지 않았다. 자세히 살펴보면 베르조서팁과 토포테칸 병용요법군의 PFS는 3.0개월로, 대조군 3.9개월 대비 길지 않았다. 반면 OS는 병용요법군에서 8.9개월로, 단독요법군 5.4개월 대비 유의한 개선을 보였다. 중간 추적 관찰 기간이 21.3개월 후, 토포테칸 단독군과 토포테칸 및 베르조서팁 군 간 PFS는 각각 3.0개월과 3.9개월로 유의하게 나타나지 않았다. 다만 병용요법군의 OS는 8.9개월로, 토포테칸군 5.4개월 대비 개선됐다. 3~4등급 혈소판감소증과 모든 등급의 메스꺼움과 같은 부작용은 두 군 간에 유사하게 나타났다.2026-01-06 12:10:26손형민 기자 -
 셀메드·세포교정의약학회, 7일부터 NAPA서 항노화 연구 공유[데일리팜=차지현 기자] 제이비케이랩(대표 장봉근, 의학·약학박사)의 브랜드 셀메드가 제13회 NAPA 국제 컨퍼런스에 참여해 항노화 해법을 모색한다고 6일 밝혔다. NAPA(Nutrition and Physical Activity on Aging, Obesity and Cancer)는 2009년 창립된 국제 학술연구 모임으로 이번 행사는 오는 7일부터 9일까지 전남 여수 베네치아 호텔&리조트에서 개최된다. 행사에는 말콤 잭슨 영국 리버풀 대학 교수 등 세계적 석학 40여 명이 참석해 항노화와 만성질환 예방에 관한 최신 지견을 나눌 예정이다. 셀메드와 세포교정의약학회(OMPA)는 이번 콘퍼런스에 참가해 세포교정영양요법(OCNT, Ortho-Cellular Nutrition Therapy)을 중심으로 한 임상 적용 사례와 연구 성과를 소개한다. OCNT는 세포 기능 저하가 노화와 질환 발생에 영향을 미친다는 관점에서 출발한 영양 요법으로, 환자의 증상과 대사 환경을 분석해 개인별 맞춤 설계를 적용하는 것이 특징이다. 세포교정의약학회는 현재 약사 정회원 3000여 명이 활동 중이며 학술지 CELLMED를 통해 약국 현장의 임상 사례 논문 150여 건을 축적해왔다. 학술대회 기간 중 셀메드 세션에서는 회원 약사들이 연자로 나서 질환별 OCNT 적용 사례를 발표한다. 난임·류마티스 관절염, 췌장암 합병증, 욕창, 부인과 및 피부 질환, 건선 등 다양한 임상 사례가 공유될 예정이다. 행사 마지막 날에는 장봉근 제이비케이랩 대표가 '항노화에서 역노화로'를 주제로 세포 기능 회복을 기반으로 한 영양 전략을 발표한다. 이와 함께 행사장 내 셀메드 부스에서는 NMN, 안토시아닌 기반 포뮬러, 커큐민·레스베라트롤 나노 제형 등 셀메드의 주요 포뮬러 기술이 소개된다. 장봉근 제이비케이랩 대표는 "이번 NAPA 컨퍼런스 참여는 셀메드 OCNT가 지향하는 세포 중심의 예방 철학이 세계적인 학술 흐름과 일치하고 있음을 확인하는 소중한 과정"이라며 "앞으로도 약사들의 전문성을 높이는 교육 프로그램을 지속적으로 운영하고, 인류의 건강한 삶에 기여할 수 있는 영양 요법 연구에 매진하겠다"고 했다.2026-01-06 11:08:31차지현 기자
셀메드·세포교정의약학회, 7일부터 NAPA서 항노화 연구 공유[데일리팜=차지현 기자] 제이비케이랩(대표 장봉근, 의학·약학박사)의 브랜드 셀메드가 제13회 NAPA 국제 컨퍼런스에 참여해 항노화 해법을 모색한다고 6일 밝혔다. NAPA(Nutrition and Physical Activity on Aging, Obesity and Cancer)는 2009년 창립된 국제 학술연구 모임으로 이번 행사는 오는 7일부터 9일까지 전남 여수 베네치아 호텔&리조트에서 개최된다. 행사에는 말콤 잭슨 영국 리버풀 대학 교수 등 세계적 석학 40여 명이 참석해 항노화와 만성질환 예방에 관한 최신 지견을 나눌 예정이다. 셀메드와 세포교정의약학회(OMPA)는 이번 콘퍼런스에 참가해 세포교정영양요법(OCNT, Ortho-Cellular Nutrition Therapy)을 중심으로 한 임상 적용 사례와 연구 성과를 소개한다. OCNT는 세포 기능 저하가 노화와 질환 발생에 영향을 미친다는 관점에서 출발한 영양 요법으로, 환자의 증상과 대사 환경을 분석해 개인별 맞춤 설계를 적용하는 것이 특징이다. 세포교정의약학회는 현재 약사 정회원 3000여 명이 활동 중이며 학술지 CELLMED를 통해 약국 현장의 임상 사례 논문 150여 건을 축적해왔다. 학술대회 기간 중 셀메드 세션에서는 회원 약사들이 연자로 나서 질환별 OCNT 적용 사례를 발표한다. 난임·류마티스 관절염, 췌장암 합병증, 욕창, 부인과 및 피부 질환, 건선 등 다양한 임상 사례가 공유될 예정이다. 행사 마지막 날에는 장봉근 제이비케이랩 대표가 '항노화에서 역노화로'를 주제로 세포 기능 회복을 기반으로 한 영양 전략을 발표한다. 이와 함께 행사장 내 셀메드 부스에서는 NMN, 안토시아닌 기반 포뮬러, 커큐민·레스베라트롤 나노 제형 등 셀메드의 주요 포뮬러 기술이 소개된다. 장봉근 제이비케이랩 대표는 "이번 NAPA 컨퍼런스 참여는 셀메드 OCNT가 지향하는 세포 중심의 예방 철학이 세계적인 학술 흐름과 일치하고 있음을 확인하는 소중한 과정"이라며 "앞으로도 약사들의 전문성을 높이는 교육 프로그램을 지속적으로 운영하고, 인류의 건강한 삶에 기여할 수 있는 영양 요법 연구에 매진하겠다"고 했다.2026-01-06 11:08:31차지현 기자 -
 라온파마, 탈모치료제 매출 116억…시장 존재감 확대[데일리팜=황병우 기자]탈모치료제 전문 제약바이오 기업 라온파마가 2025년 연매출 149억원 중 남성형 탈모치료제로 연간 116억원 매출액을 올렸다고 5일 밝혔다. 라온파마는 남성형 탈모치료제 프로페시아정(피나스테리드1mg)의 제네릭(복제약)인 피나온정1mg와 아보다트연질캡슐(두타스테리드0.5mg)의 제네릭인 두타윈연질캡슐0.5mg를 대표제품으로 보유하고 있다. 지난1월~12월 남성형 탈모치료제를 4400만정(캡슐)를 유통 판매했으며, 국내 동일제형 제네릭 성분 제품 중 높은 판매량이다. 또한 미녹시딜 성분의 미녹시폼에어로솔5%(폼타입), 미녹신정5mg(정제) 역시 남녀 탈모치료제로 매출을 확대하고 있다. 특히 지난 5월에 출시한 미녹시폼에어로솔5%는 로게인5%에어로졸(미녹시딜)의 제네릭 제품이다. 국내에서 미녹시딜 폼타입으로는 제네릭 최초로 출시됐다. 폼 타입 탈모치료 외용제이기에 액상형 제형보다 두피에 바를 때 흘러내림이 적어 사용이 편리하다. 박하향을 추가해 두피에 적용시 청량감을 줬다. 남성형, 여성형 탈모증 치료 적응증을 모두 받았다. 그 외 탈모보조제 판시온캡슐, 기능성화장품 탈모증상완화 샴푸 라온샴푸도 탈모시장에서 꾸준한 성장세를 보이고 있다. 라온파마 관계자는 국내 탈모관련 학술대회에 참가, 탈모치료제 시장에서 탄탄한 매출 성장을 바탕으로 단순 영업마케팅, 유통을 넘어 탈모치료제 신약 개발 투자 및 연구 역량도 강화하고 있다. 앞으로 국내 최고의 탈모치료제 전문 제약바이오 기업으로 성장할 계획이라고 포부를 밝혔다.2026-01-05 10:21:30황병우 기자
라온파마, 탈모치료제 매출 116억…시장 존재감 확대[데일리팜=황병우 기자]탈모치료제 전문 제약바이오 기업 라온파마가 2025년 연매출 149억원 중 남성형 탈모치료제로 연간 116억원 매출액을 올렸다고 5일 밝혔다. 라온파마는 남성형 탈모치료제 프로페시아정(피나스테리드1mg)의 제네릭(복제약)인 피나온정1mg와 아보다트연질캡슐(두타스테리드0.5mg)의 제네릭인 두타윈연질캡슐0.5mg를 대표제품으로 보유하고 있다. 지난1월~12월 남성형 탈모치료제를 4400만정(캡슐)를 유통 판매했으며, 국내 동일제형 제네릭 성분 제품 중 높은 판매량이다. 또한 미녹시딜 성분의 미녹시폼에어로솔5%(폼타입), 미녹신정5mg(정제) 역시 남녀 탈모치료제로 매출을 확대하고 있다. 특히 지난 5월에 출시한 미녹시폼에어로솔5%는 로게인5%에어로졸(미녹시딜)의 제네릭 제품이다. 국내에서 미녹시딜 폼타입으로는 제네릭 최초로 출시됐다. 폼 타입 탈모치료 외용제이기에 액상형 제형보다 두피에 바를 때 흘러내림이 적어 사용이 편리하다. 박하향을 추가해 두피에 적용시 청량감을 줬다. 남성형, 여성형 탈모증 치료 적응증을 모두 받았다. 그 외 탈모보조제 판시온캡슐, 기능성화장품 탈모증상완화 샴푸 라온샴푸도 탈모시장에서 꾸준한 성장세를 보이고 있다. 라온파마 관계자는 국내 탈모관련 학술대회에 참가, 탈모치료제 시장에서 탄탄한 매출 성장을 바탕으로 단순 영업마케팅, 유통을 넘어 탈모치료제 신약 개발 투자 및 연구 역량도 강화하고 있다. 앞으로 국내 최고의 탈모치료제 전문 제약바이오 기업으로 성장할 계획이라고 포부를 밝혔다.2026-01-05 10:21:30황병우 기자 -
![[기자의 눈] 아시아로 향하는 글로벌 임상, 한국의 전략은](https://vod.dailypharm.com/new_dailypharm/editor/content/2025/12/22/31cb9950-2d7e-43c7-bc17-468bdda085e9.jpg) [기자의 눈] 아시아로 향하는 글로벌 임상, 한국의 전략은[데일리팜=손형민 기자] 얼마 전 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025'의 주요 화두는 단순히 글로벌 제약사들이 아시아인 서브그룹 데이터를 제시했다는 데 그치지 않았다. 이번 학회에서 확인된 변화는 임상 성과가 만들어지는 무대와, 그 성과를 따라 움직이는 투자와 개발 전략의 무게중심이 아시아로 이동하고 있다는 점이다. 이 같은 흐름을 가장 직접적으로 드러낸 사례가 이번 ESMO ASIA에서의 아스트라제네카 발표였다. 아스트라제네카에 따르면 현재 소화기암 임상시험에 참여하는 환자의 60~70%가 아시아에서 모집되고 있다. 연구는 아시아 데이터를 기반으로 구성되고 있으며 이 지역 전반에서 약 50개의 활성 임상시험 사이트가 운영 중이다. 단순히 참여 비중을 넘어 임상 성과의 신뢰도를 좌우하는 핵심 근거가 아시아에서 만들어지고 있다는 의미다. 향후 신약 허가와 급여 논의에서도 아시아 중심의 데이터 반영이 불가피해질 것이라는 전망이 나오는 이유다. 이제 글로벌 제약사가 던지는 메시지는 분명해지고 있다. 아시아는 더 이상 글로벌 임상의 하위 분석 대상이 아니라, 임상 성과가 먼저 만들어지고 신약개발 전략이 출발하는 지점이 되고 있다. 하위군 분석이 아닌 주요 평가지표의 무게가 아시아로 이동하는 날도 머지않았다는 신호다. 이 변화의 흐름 속에서 한국의 역할은 더욱 중요해진다. 아시아가 하나의 덩어리가 아닌 이상 어떤 국가의 어떤 기업을 전략 파트너로 선택될 것인지는 결국 각 기업의 준비도에 달려 있다. 아시아가 중심이 된 임상과 투자 재편 속에서 한국이 어떤 자리를 차지할 것인지에 대한 질문은 이제 피할 수 없는 과제가 되고 있다. 임상 성과의 이동은 자연스럽게 글로벌 제약사의 투자 전략 변화로 이어진다. 개발 초기 단계부터 후기 임상, 병용 전략, 후속 연구까지 아시아를 중심에 두려는 움직임이 뚜렷해지고 있다. 임상과 투자가 동시에 이동하는 구조가 만들어지고 있는 셈이다. 이 과정에서 특히 눈에 띄는 변화는 중국의 존재감이다. 중국은 더 이상 환자 수가 많은 나라에 머물지 않는다. 국가 차원의 임상 인프라 확충, 규제 혁신, 자본 투입을 바탕으로 초기 임상부터 후기 3상까지 독자적으로 끌고 갈 수 있는 역량을 빠르게 축적하고 있다. 글로벌 제약사가 중국 바이오텍을 개발 파트너로 삼아 임상 전략을 설계하는 사례도 늘고 있다. 중국의 강점은 속도와 규모에 그치지 않는다. 특정 기전과 적응증에서는 중국이 글로벌 개발의 출발점이 되는 장면도 나타난다. 이는 아시아로 이동하는 임상과 투자가 다시 중국으로 수렴될 수 있음을 시사한다. 그간 한국은 오랫동안 글로벌 임상에서 신뢰 가능한 임상 수행국으로 자리 잡아왔다. 빠른 환자 모집, 우수한 의료 인프라는 분명한 강점이다. 그러나 중국이 설계와 주도를 강화하는 상황에서 수행 역량만으로는 전략적 존재감을 유지하기 어렵다. 글로벌 제약사가 아시아에서 찾는 것은 단순히 많은 환자가 아니라 개발 전략을 함께 논의할 수 있는 파트너다. 임상 설계 단계에서의 관여, 특정 환자군에 대한 해석 역량, 후속 연구를 주도할 수 있는 연구 생태계가 중요해지고 있다. 한국은 단순 참여국을 넘어 임상 설계·해석·확장의 역할을 맡을 수 있는 조건을 갖췄다. 대형 상급종합병원을 중심으로 한 전문 진료 역량, 특정 암종과 환자군에 대한 축적된 경험, 빠른 데이터 생산 속도는 아시아 내에서도 경쟁력이 있다. 문제는 이 역량이 개별 연구자나 기관 단위에 머무르고 국가 차원의 전략으로 묶이지 못하고 있다는 점이다. 아시아로의 이동은 모든 국가에 동일한 기회를 주지 않는다. 임상 수행국은 많지만, 성과가 쌓이고 투자가 이어지는 국가는 제한적이다. 중국이 빠르게 개발 주도국으로 이동하는 지금, 한국에 필요한 것은 얼마나 참여하느냐가 아니라 어디까지 관여하느냐에 대한 선택이다.2025-12-23 06:00:44손형민 기자
[기자의 눈] 아시아로 향하는 글로벌 임상, 한국의 전략은[데일리팜=손형민 기자] 얼마 전 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025'의 주요 화두는 단순히 글로벌 제약사들이 아시아인 서브그룹 데이터를 제시했다는 데 그치지 않았다. 이번 학회에서 확인된 변화는 임상 성과가 만들어지는 무대와, 그 성과를 따라 움직이는 투자와 개발 전략의 무게중심이 아시아로 이동하고 있다는 점이다. 이 같은 흐름을 가장 직접적으로 드러낸 사례가 이번 ESMO ASIA에서의 아스트라제네카 발표였다. 아스트라제네카에 따르면 현재 소화기암 임상시험에 참여하는 환자의 60~70%가 아시아에서 모집되고 있다. 연구는 아시아 데이터를 기반으로 구성되고 있으며 이 지역 전반에서 약 50개의 활성 임상시험 사이트가 운영 중이다. 단순히 참여 비중을 넘어 임상 성과의 신뢰도를 좌우하는 핵심 근거가 아시아에서 만들어지고 있다는 의미다. 향후 신약 허가와 급여 논의에서도 아시아 중심의 데이터 반영이 불가피해질 것이라는 전망이 나오는 이유다. 이제 글로벌 제약사가 던지는 메시지는 분명해지고 있다. 아시아는 더 이상 글로벌 임상의 하위 분석 대상이 아니라, 임상 성과가 먼저 만들어지고 신약개발 전략이 출발하는 지점이 되고 있다. 하위군 분석이 아닌 주요 평가지표의 무게가 아시아로 이동하는 날도 머지않았다는 신호다. 이 변화의 흐름 속에서 한국의 역할은 더욱 중요해진다. 아시아가 하나의 덩어리가 아닌 이상 어떤 국가의 어떤 기업을 전략 파트너로 선택될 것인지는 결국 각 기업의 준비도에 달려 있다. 아시아가 중심이 된 임상과 투자 재편 속에서 한국이 어떤 자리를 차지할 것인지에 대한 질문은 이제 피할 수 없는 과제가 되고 있다. 임상 성과의 이동은 자연스럽게 글로벌 제약사의 투자 전략 변화로 이어진다. 개발 초기 단계부터 후기 임상, 병용 전략, 후속 연구까지 아시아를 중심에 두려는 움직임이 뚜렷해지고 있다. 임상과 투자가 동시에 이동하는 구조가 만들어지고 있는 셈이다. 이 과정에서 특히 눈에 띄는 변화는 중국의 존재감이다. 중국은 더 이상 환자 수가 많은 나라에 머물지 않는다. 국가 차원의 임상 인프라 확충, 규제 혁신, 자본 투입을 바탕으로 초기 임상부터 후기 3상까지 독자적으로 끌고 갈 수 있는 역량을 빠르게 축적하고 있다. 글로벌 제약사가 중국 바이오텍을 개발 파트너로 삼아 임상 전략을 설계하는 사례도 늘고 있다. 중국의 강점은 속도와 규모에 그치지 않는다. 특정 기전과 적응증에서는 중국이 글로벌 개발의 출발점이 되는 장면도 나타난다. 이는 아시아로 이동하는 임상과 투자가 다시 중국으로 수렴될 수 있음을 시사한다. 그간 한국은 오랫동안 글로벌 임상에서 신뢰 가능한 임상 수행국으로 자리 잡아왔다. 빠른 환자 모집, 우수한 의료 인프라는 분명한 강점이다. 그러나 중국이 설계와 주도를 강화하는 상황에서 수행 역량만으로는 전략적 존재감을 유지하기 어렵다. 글로벌 제약사가 아시아에서 찾는 것은 단순히 많은 환자가 아니라 개발 전략을 함께 논의할 수 있는 파트너다. 임상 설계 단계에서의 관여, 특정 환자군에 대한 해석 역량, 후속 연구를 주도할 수 있는 연구 생태계가 중요해지고 있다. 한국은 단순 참여국을 넘어 임상 설계·해석·확장의 역할을 맡을 수 있는 조건을 갖췄다. 대형 상급종합병원을 중심으로 한 전문 진료 역량, 특정 암종과 환자군에 대한 축적된 경험, 빠른 데이터 생산 속도는 아시아 내에서도 경쟁력이 있다. 문제는 이 역량이 개별 연구자나 기관 단위에 머무르고 국가 차원의 전략으로 묶이지 못하고 있다는 점이다. 아시아로의 이동은 모든 국가에 동일한 기회를 주지 않는다. 임상 수행국은 많지만, 성과가 쌓이고 투자가 이어지는 국가는 제한적이다. 중국이 빠르게 개발 주도국으로 이동하는 지금, 한국에 필요한 것은 얼마나 참여하느냐가 아니라 어디까지 관여하느냐에 대한 선택이다.2025-12-23 06:00:44손형민 기자 -
 배승진·한은아 교수, 사회약학회 중견사회약학자상 수상[데일리팜=정흥준 기자]배승진 이화여대 약학대학 교수와 한은아 연세대 약학대학 교수가 한국사회약학회 중견사회약학자상을 수상했다. 12일 한국사회약학회(회장 장선미)는 성균관대 인문사회캠퍼스에서 개최한 학술대회에서 중견사회약학자 수상자를 발표했다. 사회약학 분야에서 박사학위 취득 후 15년 이상 연구, 저술, 교육 등을 통해 학문 발전에 기여한 약학자를 선정했다. 또 학회 다양한 활동을 통해 학회 발전에 공헌한 공로가 큰 연구자에게 상을 수여해 향후 10년 이상의 지속적인 활동을 격려했다. 수상자인 배승진 교수는 심평원 약평위 경제성평가 소위원회 위원과 위원장을 역임했다. 한국보건의료기술평가학회(KAHTA) 총무위원장과 감사를 역임하고 현재 국제위원장을 맡고 있다. 약학회에서는 회원위원회 위원장으로 활동하고 있다. 한은아 교수는 심평원 약평위, 위험분담제소위원회에서 활동하고 있다. 또 건보공단 국민건강정보자료제공 심의위원회, 식약처 장애인 의약외품 안전사용 정책협의체에 참여하고 있다. 보건경제정책학회에서는 교육이사를 거쳐 부회장을 역임했다.2025-12-18 14:53:09정흥준 기자
배승진·한은아 교수, 사회약학회 중견사회약학자상 수상[데일리팜=정흥준 기자]배승진 이화여대 약학대학 교수와 한은아 연세대 약학대학 교수가 한국사회약학회 중견사회약학자상을 수상했다. 12일 한국사회약학회(회장 장선미)는 성균관대 인문사회캠퍼스에서 개최한 학술대회에서 중견사회약학자 수상자를 발표했다. 사회약학 분야에서 박사학위 취득 후 15년 이상 연구, 저술, 교육 등을 통해 학문 발전에 기여한 약학자를 선정했다. 또 학회 다양한 활동을 통해 학회 발전에 공헌한 공로가 큰 연구자에게 상을 수여해 향후 10년 이상의 지속적인 활동을 격려했다. 수상자인 배승진 교수는 심평원 약평위 경제성평가 소위원회 위원과 위원장을 역임했다. 한국보건의료기술평가학회(KAHTA) 총무위원장과 감사를 역임하고 현재 국제위원장을 맡고 있다. 약학회에서는 회원위원회 위원장으로 활동하고 있다. 한은아 교수는 심평원 약평위, 위험분담제소위원회에서 활동하고 있다. 또 건보공단 국민건강정보자료제공 심의위원회, 식약처 장애인 의약외품 안전사용 정책협의체에 참여하고 있다. 보건경제정책학회에서는 교육이사를 거쳐 부회장을 역임했다.2025-12-18 14:53:09정흥준 기자 -
 라온파마, 레이저피부모발 국제학회 참가…탈모약 라인업 공유[데일리팜=이석준 기자] 탈모치료제 전문 제약바이오 기업 라온파마는 지난 14일 그랜드 인터컨티넨탈 파르나스 서울에서 열린 대한레이저피부모발학회 제51차 추계 국제학술대회에 참가했다고 16일 밝혔다. 대한레이저피부모발학회는 피부미용,비만,탈모 분야의 학문적 발전에 기여하기 위해 국내외 전문 의료인 및 관련 업체들이 지식을 공유하는 단체다. 6000여명의 의사 회원과 50여명의 상임 학술이사를 중심으로 학술대회, 심포지엄, 아카데미 등 활발히 운영되고 있다. 라온파마(대표 박덕천, 손재현)는 2018년에 설립된 제약바이오 기업으로 탈모치료제에 특화된 기업이다. 이번 행사에서 탈모치료제 피나온정1mg(피나스테리드), 두타윈연질캡슐0.5mg(두타스테리드), 판시온캡슐(케라틴 외), 미녹시폼에어로솔5%(미녹시딜), 미녹신정5mg(미녹시딜) 라온샴푸(비오틴, 카페인, 글루타티온 외 기능성 탈모샴푸)을 선보였다. 대표 탈모치료제인 피나온정, 두타윈연질캡슐은 연간 100억원이상 매출을 올리고 있다. 이번 학술대회에서 부산우리연합의원 이호준 원장의 강의 'Comprehensive Overview of Topical Treatments for Alopecia(최신 도포형 탈모치료약 총정리)'를 통해 미녹시폼에어로솔5%를 참가 의료인들에게 소개할수 있는 시간을 가졌다. 미녹시폼에어로솔5% 미녹시딜 성분을 폼타입으로는 국내 제네릭 최초 제품이며, 남성형, 여성형 탈모 적응증, 경제적인 가격, 박하향, 폼타입 등의 강점을 갖고 있다. 라온파마 관계자는 "이번 학회를 통해 많은 의료인에게 자사 대표 브랜드 탈모치료제를 강의, 영업마케팅 할수 있는 좋은 자리였다. 또한 탈모 신약 개발에도 꾸준히 투자해 국내 No.1 탈모치료제 전문 제약바이오 기업으로 더욱 성장해 나갈 계획"이라고 밝혔다.2025-12-16 09:35:41이석준 기자
라온파마, 레이저피부모발 국제학회 참가…탈모약 라인업 공유[데일리팜=이석준 기자] 탈모치료제 전문 제약바이오 기업 라온파마는 지난 14일 그랜드 인터컨티넨탈 파르나스 서울에서 열린 대한레이저피부모발학회 제51차 추계 국제학술대회에 참가했다고 16일 밝혔다. 대한레이저피부모발학회는 피부미용,비만,탈모 분야의 학문적 발전에 기여하기 위해 국내외 전문 의료인 및 관련 업체들이 지식을 공유하는 단체다. 6000여명의 의사 회원과 50여명의 상임 학술이사를 중심으로 학술대회, 심포지엄, 아카데미 등 활발히 운영되고 있다. 라온파마(대표 박덕천, 손재현)는 2018년에 설립된 제약바이오 기업으로 탈모치료제에 특화된 기업이다. 이번 행사에서 탈모치료제 피나온정1mg(피나스테리드), 두타윈연질캡슐0.5mg(두타스테리드), 판시온캡슐(케라틴 외), 미녹시폼에어로솔5%(미녹시딜), 미녹신정5mg(미녹시딜) 라온샴푸(비오틴, 카페인, 글루타티온 외 기능성 탈모샴푸)을 선보였다. 대표 탈모치료제인 피나온정, 두타윈연질캡슐은 연간 100억원이상 매출을 올리고 있다. 이번 학술대회에서 부산우리연합의원 이호준 원장의 강의 'Comprehensive Overview of Topical Treatments for Alopecia(최신 도포형 탈모치료약 총정리)'를 통해 미녹시폼에어로솔5%를 참가 의료인들에게 소개할수 있는 시간을 가졌다. 미녹시폼에어로솔5% 미녹시딜 성분을 폼타입으로는 국내 제네릭 최초 제품이며, 남성형, 여성형 탈모 적응증, 경제적인 가격, 박하향, 폼타입 등의 강점을 갖고 있다. 라온파마 관계자는 "이번 학회를 통해 많은 의료인에게 자사 대표 브랜드 탈모치료제를 강의, 영업마케팅 할수 있는 좋은 자리였다. 또한 탈모 신약 개발에도 꾸준히 투자해 국내 No.1 탈모치료제 전문 제약바이오 기업으로 더욱 성장해 나갈 계획"이라고 밝혔다.2025-12-16 09:35:41이석준 기자 -
 자폐스펙트럼연구회, 발달장애인 법·의학·현장 이슈 조명[데일리팜=이정환 기자] 대한소아청소년정신의학회 산하 대한자폐스펙트럼연구회(이하 연구회)가 '발달장애와 법-발달장애인 관련 법과 형사소송 절차 개선 방안을 중심으로'를 주제로 한 2025 동계 학술대회를 최근 개최하고 발달 장애인들의 현실적 문제를 논의했다. 이번 학술대회는 발달장애인의 행동 특성과 법적 판단 사이에서 발생하는 문제들을 법률·의학·사회적 관점에서 종합적으로 살피기 위해 마련됐다. 이주현 연구회 회장은 "2005년 영화 말아톤에서 얼룩말을 좋아하는 자폐 당사자 주인공이 지하철에서 얼룩말 무늬 치마를 만지는 바람에 그의 엄마가 계속해서 사과를 하고, 그 여성은 욕설을 내뱉으며 자리를 떠나는 장면이 나온다"며 "지금은 이런 상황이 발생하면 형사적으로 고소당하는 현실"이라며 발달장애인과 함께 살 수 있는 사회적 장치의 필요성을 제기했다. 뒤 이어 천근아 대한소아청소년정신의학회 이사장과 곽영숙 국립정신건강센터장이 직접 참석해 축사를 전했다. 천근아 이사장과 곽영숙 센터장은 발달장애인이 일상에서 겪는 법적·제도적 어려움에 대한 공감과 함께, 사회적 안전망 확충의 필요성을 강조하며 학술대회 개최를 축하했다. 환영했다. 특히 개혁신당 이주영 국회의원은 영상 축사에서 발달장애 관련 법·제도 개선에 지속적으로 힘쓰겠다는 메시지를 전하며 축하를 보냈다. 행사는 제1부와 제2부로 나뉘어 발표가 이어졌다. 제1부에서는 양찬모(원광의대) 교수의 법정신의학적 이슈 강연, 이혜림 사법정책연구원 부장판사의 형사소송절차 개선 방안 발표, 그리고 이주언 공익법단체 두루 변호사의 사례 기반 법 해석 발표가 진행됐다. 제2부에서는 이지원(순천향의대) 교수가 임상현장에서 마주하는 법률 문제를 설명했고, 추국화 노원청소년상담센터 박사가 발달장애인의 피해·가해 상황에 대한 재발 방지 및 보호 프로그램을 소개했다. 참석자들은 발달장애인의 법적 판단 과정에서 특성을 고려한 다각적 접근이 필요하다는 데 의견을 같이했으며, 실제 현장에서 활용 가능한 정책적·제도적 대안을 모색하는 계기가 되었다고 평가했다. 특히 이혜림 부장판사는 발달장애인이 피의자가 되었을 경우에도 의사소통의 제한을 고려하여 신뢰관계인 동석이나 진술보조 등의 절차적 개선방안의 필요성을 제안했다. 대한자폐스펙트럼연구회는 “이번 학술대회가 발달장애인의 권리와 안전을 지키는 법적·사회적 기반을 마련하는 중요한 출발점이 되었다”며 “향후에도 다양한 분야와 협력해 실질적인 개선 방안을 마련해 나가겠다”고 밝혔다.2025-12-15 10:40:06이정환 기자
자폐스펙트럼연구회, 발달장애인 법·의학·현장 이슈 조명[데일리팜=이정환 기자] 대한소아청소년정신의학회 산하 대한자폐스펙트럼연구회(이하 연구회)가 '발달장애와 법-발달장애인 관련 법과 형사소송 절차 개선 방안을 중심으로'를 주제로 한 2025 동계 학술대회를 최근 개최하고 발달 장애인들의 현실적 문제를 논의했다. 이번 학술대회는 발달장애인의 행동 특성과 법적 판단 사이에서 발생하는 문제들을 법률·의학·사회적 관점에서 종합적으로 살피기 위해 마련됐다. 이주현 연구회 회장은 "2005년 영화 말아톤에서 얼룩말을 좋아하는 자폐 당사자 주인공이 지하철에서 얼룩말 무늬 치마를 만지는 바람에 그의 엄마가 계속해서 사과를 하고, 그 여성은 욕설을 내뱉으며 자리를 떠나는 장면이 나온다"며 "지금은 이런 상황이 발생하면 형사적으로 고소당하는 현실"이라며 발달장애인과 함께 살 수 있는 사회적 장치의 필요성을 제기했다. 뒤 이어 천근아 대한소아청소년정신의학회 이사장과 곽영숙 국립정신건강센터장이 직접 참석해 축사를 전했다. 천근아 이사장과 곽영숙 센터장은 발달장애인이 일상에서 겪는 법적·제도적 어려움에 대한 공감과 함께, 사회적 안전망 확충의 필요성을 강조하며 학술대회 개최를 축하했다. 환영했다. 특히 개혁신당 이주영 국회의원은 영상 축사에서 발달장애 관련 법·제도 개선에 지속적으로 힘쓰겠다는 메시지를 전하며 축하를 보냈다. 행사는 제1부와 제2부로 나뉘어 발표가 이어졌다. 제1부에서는 양찬모(원광의대) 교수의 법정신의학적 이슈 강연, 이혜림 사법정책연구원 부장판사의 형사소송절차 개선 방안 발표, 그리고 이주언 공익법단체 두루 변호사의 사례 기반 법 해석 발표가 진행됐다. 제2부에서는 이지원(순천향의대) 교수가 임상현장에서 마주하는 법률 문제를 설명했고, 추국화 노원청소년상담센터 박사가 발달장애인의 피해·가해 상황에 대한 재발 방지 및 보호 프로그램을 소개했다. 참석자들은 발달장애인의 법적 판단 과정에서 특성을 고려한 다각적 접근이 필요하다는 데 의견을 같이했으며, 실제 현장에서 활용 가능한 정책적·제도적 대안을 모색하는 계기가 되었다고 평가했다. 특히 이혜림 부장판사는 발달장애인이 피의자가 되었을 경우에도 의사소통의 제한을 고려하여 신뢰관계인 동석이나 진술보조 등의 절차적 개선방안의 필요성을 제안했다. 대한자폐스펙트럼연구회는 “이번 학술대회가 발달장애인의 권리와 안전을 지키는 법적·사회적 기반을 마련하는 중요한 출발점이 되었다”며 “향후에도 다양한 분야와 협력해 실질적인 개선 방안을 마련해 나가겠다”고 밝혔다.2025-12-15 10:40:06이정환 기자 -
 "임핀지, 위암 보조요법서 면역항암제 활용 근거 제시"[데일리팜=손형민 기자] 수술이 가능한 위암·위식도접합부(GEJ) 선암에서도 약물 보조요법의 필요성이 대두되고 있다. 동아시아는 조기 진단과 수술 성적이 뛰어난 지역이지만, 2–3기 국소 진행성 환자군에서는 미세전이 잔존으로 인한 재발 위험이 여전히 남는다. 이런 맥락에서 수술 전과 수술 후에 항암제를 투여하는 전주기(Perioperative) 치료 전략이 치료 성과를 끌어올릴 수 있는 해법으로 부상해왔다. 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025'에서는 아스트라제네카의 면역항암제 '임핀지(더발루맙)'+표준 항암화학요법 FLOT(5-FU·류코보린·옥살리플라틴·도세탁셀) 병용요법의 가치를 확인한 MATTERHORN 임상3상 연구의 아시아인 하위분석이 소개됐다. 해당 임상에서 임핀지+FLOT은 글로벌 연구와 마찬가지로 위약+FLOT 대비 무사건생존(EFS)과 3년 전체생존율(OS), 병리학적 완전반응률(pCR) 개선까지 보고됐다. 이는 수술 가능한 위암에서 면역항암제의 역할이 앞단으로 이동하고 있다는 신호를 분명히 했다는 평가가 나온다. 위암 완치를 위한 치료의 근간은 여전히 수술이다. 그러나 아시아를 포함해 전 세계적으로 많은 위암 환자에서 수술 단독으로는 완치를 기대하기 어렵다는 인식이 확산되고 있다. MATTERHORN 연구는 수술 전에 면역항암제와 FLOT을 병용 투여하고, 근치적 절제술을 시행한 후 추가 치료를 이어가는 전략이 장기적인 치료 성과를 의미 있게 향상시킬 수 있음을 보여줬다. 해당 임상 결과를 토대로 미국 식품의약국(FDA)은 지난달 절제 가능한 위암·위식도접합부 선암 성인 환자에서 FLOT 병용 이후 임핀지 단독 유지요법을 승인했다. 이 같은 변화의 임상적 의미와 국내 적용 과제를 두고 MATTERHORN 연구 제1저자 엘레나 얀지기안 박사(미국 메모리얼 슬론 케터링 암센터 위장관종양내과 책임자)와, 연세암병원 종양내과 라선영 교수(대한암학회 이사장)를 ESMO ASIA 2025 현장에서 만나 이야기를 들었다. Q. MATTERHORN 임상 연구의 제1저자로서, 절제 가능한 위암 및 위식도접합부 선암 환자에서 수술 전·후 면역항암요법 전략을 추진한 배경이 궁금하다. 연구 결과 및 임상적 의의와 함께 설명 부탁드린다. 엘레나 얀지기안 박사: MATTERHORN 임상 연구는 절제 가능한 조기 단계 환자군에서 면역항암제-FLOT 병용을 통해 pCR, EFS, OS 모두에서 개선을 확인한 최초의 3상 임상 연구라는 점에서 큰 의의를 지닌다. 이번 학회에서는 일본, 한국, 대만 등 아시아 환자군을 대상으로 한 하위 분석 결과를 발표했는데, 아시아 환자에서도 글로벌 결과와 일관된 경향을 보였다. 이는 전주기 요법이 전 세계적으로 적용 가능함을 뒷받침한다. 최근 FDA가 절제 가능한 모든 위암 및 위식도접합부 선암에서 임핀지 수술 전·후 보조요법을 승인함에 따라, 지역 간 치료 전략을 조화시키는 것은 치료 분야 발전에 더욱 기여할 수 있을 것이다. 이는 매년 120만 명 이상이 위암으로 새롭게 진단되는 전 세계적인 질병 부담을 고려할 때 더욱 중요하다. Q. 아시아 환자에서도 글로벌 결과와 동일한 유효성과 안전성 경향이 확인됐다. 엘레나 얀지기안 박사: 이번 연구에서 가장 주목해야 할 점은 세 가지다. 첫번째는 지역 간 적용 가능성(feasibility across regions)이다. 임핀지 수술 전·후 보조요법은 아시아 의료기관에서도 충분히 투여 가능했으며, 의료진은 임핀지와 FLOT 모두 안전하게 투여할 수 있었다. 또 수술적 치료를 저해하지 않았다. 완전 절제(R0 resection) 비율과 수술 시행 가능성은 유지됐다. 여기에 주요 세 가지 유효성 지표인 pCR, EFS, OS가 동시에 개선됐다. 이는 위암 치료 환경에서 전례 없는 성과로, MATTEHRORN 임상 연구의 견고한 가치를 뒷받침한다. Q. 임핀지 수술 전·후 보조요법을 초기 단계 환자에게 적용할 때 의료진이 고려해야 할 점은 무엇인가? 엘레나 얀지기안 박사: 이번 연구에는 18세부터 84세까지 폭넓은 연령대의 환자가 참여했으며, 고령 환자에서도 젊은 환자와 유사한 치료 혜택이 확인됐다. 다만 일부 환자, 특히 아시아 환자에서는 영양 상태가 저하돼 있거나 백혈구 수치가 낮게 나타나는 경우가 있다. 아시아 연구진은 이러한 특성을 잘 이해하고 있으며, G-CSF의 조기 예방적 투여나 초기 FLOT의 초기 용량을 세심하게 조절하는 전략을 통해 안전성을 유지하며 치료 효과를 보존하는 데 도움이 될 수 있다. 무엇보다도 면밀한 임상 모니터링, 적절한 수액 요법, 체계적인 지지요법은 수술 전·후 치료를 성공적으로 완수하는 데 필수적 요소다. Q. 한국 의료진 사이에서는 임핀지 수술 전·후 보조요법이 2기보다 3기 또는 4기 위암 환자에 더 적합할 것이라는 의견도 있다. 이에 대한 견해가 궁금하다. 엘레나 얀지기안 박사: 위암의 임상 병기는 종종 부정확할 수 있다. 임상적으로 T2로 분류된 환자가 실제 수술에서는 T3 혹은 림프절 양성으로 확인되는 경우도 있다. 또한 광범위한 위 절제술 이후에는 많은 환자가 강도 높은 수술 후 보조요법을 견디기 어렵기 때문에 수술 전 보조요법의 가치가 더욱 높아진다. 면역항암제+FLOT 병용요법의 최대 효과가 종양이 아직 절제되지 않은 수술 전 치료에서 나타난다고 보고 있다. 이는 항종양 T세포의 활성화 및 확장이 최적으로 이뤄질 수 있기 때문이다. 실제로 수술 후 보조요법만 진행하는 것보다 수술 전 보조요법에서 더욱 높은 치료 혜택이 관찰된 것도 이를 뒷받침한다. 개인적으로는 임상 현장에서 T2로 추정되는 환자라도 하더라도, 미만성 또는 반지세포암 조직형을 가진 경우에는 특히 다학제적 논의를 통해 전·후 전신치료를 고려하고 있다. 더불어 아시아에서 종양 역학이 변화하며, 근위부와 위식도접합부 암이 증가하고 있다는 점도 중요하다. 이러한 종양은 전통적으로 수술 성적이 좋지 않았기 때문에, 종양 병기 하향을 목표로 한 접근의 필요성이 더욱 중요해지고 있다. Q. 초기 위암에서 비수술적 치료의 가능성을 어떻게 해석해야 하는가? 엘레나 얀지기안 박사: 이 분야는 여전히 매우 탐색적이며, 임상 연구 또는 전문 센터에서 극히 제한된 환자에게만 적용되고 있다. 일부 환자에서는 임상적·병리학적 완전반응을 달성하고, 고강도의 추적 관찰을 충실히 이행할 수 있는 경우에 한해 비수술 전략이 검토된 바 있다. 그러나 이는 표준 치료가 아니며, 특히 외과 의사들 사이에서는 여전히 논쟁이 많다. 그럼에도 이러한 논의는 완치를 목표로 하면서도 장기적인 삶의 질을 균형 있게 고려하려는 흐름의 확대를 반영한다. 위절제술은 최소 침습 수술이라 하더라도 식습관, 수면 패턴, 신체에 변화를 발생시킨다. 따라서 근거가 충분히 확보되고 엄격한 모니터링이 뒷받침되는 조건 하에 선택된 환자에서 위를 보존할 수 있다면, 이는 의미 있는 진전이 될 수 있다. 다만 이러한 접근이 널리 적용되기 위해서는 추가 연구가 반드시 필요하다. Q. 위암은 비교적 수술 성적이 양호한 것으로 알려져 있어 항암치료의 중요성이 상대적으로 덜 조명돼 왔다. 그럼에도 불구하고 MATTERHORN 연구는 수술 전·후 보조요법의 가치를 강조하고 있는데, 위암에서 이러한 치료 전략이 필요한 이유는 무엇인가? 라선영 교수: MATTERHORN 연구는 수술적 완치가 가능한 2기와 3기 진행성 위암 환자를 대상으로 진행됐다. 흔히 조기 위암(EGC)이라고 부르는 1기 위암은 내시경 절제 또는 위 절제술만으로 충분히 완치를 기대할 수 있는 단계로, 종양이 T1 병변인 점막과 점막하층에 국한된 위암을 의미한다. 반면, 2기와 3기 위암은 국소 진행성이며 재발 위험이 높다. 한국, 일본, 중국 등 동아시아에서는 국가 검진 체계와 숙련된 외과적 술기 덕분에 수술 후 보조항암요법만으로도 5년 생존율이 75~80%에 이른다. 그럼에도 불구하고 3기 환자의 약 30~40%에서는 재발을 경험하고 있어, 여전히 미충족 수요가 존재한다. 수술 전·후 보조요법은 수술 후에도 남아 있을 수 있는 미세전이를 제거하고, 이후 전신적 질병 조절을 지속하는 것을 목표로 한다. 미국과 유럽 등 서구에서는 비만 인구 증가, 위식도접합부 종양의 범위 차이 등을 고려해 종양 절제율을 높이기 위한 목적으로 이미 FLOT을 기반으로 한 수술 전·후 보조요법 치료 전략이 표준으로 자리잡았다. Q. MATTERHRON 연구의 핵심 결과는 무엇이며, 어떤 환자에서 의미가 있을지? 라선영 교수: MATTEHRORN 연구는 국소 진행성, 절제 가능한 위암 환자에게 새로운 치료 옵션을 제시했다는 점에서 의미가 크다. 특히 종양 부담이 큰 3기 고위험군에서 생존 혜택이 뚜렷하게 나타났다는 점이 주목할 만하다. 또한 전체생존율 곡선에서 5년 시점에 50%를 상회할 가능성이 높다는 점도 고무적이다. 다만 이번 연구는 한국과 일본이 오랜 기간 사용해온 수술 후 보조항암요법이 아니라, 글로벌 표준치료인 FLOT을 대조군으로 비교한 연구라는 점을 유념해야 한다. FLOT은 매우 효과적인 요법이지만, 상대적으로 높은 약물 강도로 인해 아시아 환자는 치료를 지속하는 데 어려움을 겪는 경우가 있다. 따라서 수술 결과가 좋은 아시아에서는 이 요법을 모든 2기와 3기 환자에게 일률적으로 적용하기보다 병기가 높고 재발 위험이 큰 환자군을 선별해 적용하는 것이 더 적절할 수 있다고 판단된다. Q. 국내에 임핀지 수술 전·후 보조요법이 도입된다면, 어떤 환자들이 가장 적절할지? 라선영 교수: MATTERHORN 연구가 장기 생존 데이터를 통해 3기 환자에서 무사건 생존율 및 전체생존율 등 지속적인 생존 이득을 확인한다면, 국내에서 3기 고위험 진행성 위암 환자를 중심으로 수술 전·후 보조요법을 우선적으로 고려할 가능성이 높다. 2기 환자의 경우 수술 후 보조항암요법만으로도 5년 생존율이 최대 80%에 이르기 때문에 임핀지 수술 전·후 보조요법이 제공할 수 있는 추가적인 이익과 높은 치료 비용 부담 및 독성 사이의 균형을 고려해야 한다. 실제로 MATTERHORN 연구에서도 수술 후 임핀지 보조요법을 완료한 환자는 40~50%에 불과했는데, 이는 특히 수술 후 FLOT 치료의 어려움을 반영하는 결과다. 미세전이 위험이 높고, 2년 내 30–40% 재발 위험을 가진 3기 환자가 가장 큰 혜택을 기대할 수 있다. 임상적으로는 광범위한 림프절 침범, T4 병기, 보다 공격적인 조직학적 아형 등 특성이 치료 결정에 중요한 기준이 될 수 있다. 앞으로는 바이오마커 기반 접근을 통해 치료 강도를 보다 세밀하게 조정하고, 불필요한 독성을 최소화하는 방향으로 발전할 것이라 생각한다. Q. MATTERHORN 연구에 참여한 아시아인 환자의 특징과 서양 환자와의 차이는 무엇인지 말씀 부탁드린다. 라선영 교수: MATTERHORN 연구에 참여한 아시아 환자의 특징 중 하나는 전반적으로 수행 능력이 좋고, 종양 부담이 비교적 낮았다는 점이다. 한국과 일본처럼 조기 진단율이 높고, 수술 성적이 우수한 국가에서는 임상 연구에 등록되는 환자들의 전반적인 컨디션이 서양 환자보다 더 양호할 가능성이 있다. 연구에서 4기 환자의 비중이 다소 높아 보일 수 있으나, 이는 절제가 불가능한 M1 전이성 환자를 의미하는 것이 아니라, 종양 침윤이 깊거나 림프절 전이가 광범위한 고위험 진행성 위암 환자로 해석하는 것이 적절하다. 이번 연구의 전체 등록 환자 중 아시아 환자는 약 20% 수준이었다. 따라서 향후 임핀지 전·후 보조요법을 실제 임상에서 적용하기 위해서는 아시아 환자 데이터를 더 축적하는 과정이 필요하다. Q. 한국에서 임핀지 수술 전·후 보조요법을 도입하기 위해서는 어떤 과제를 해결해야 한다고 보는가? 라선영 교수: 무엇보다 외과 전문의와 종양내과 전문의 간 치료 접근 방식을 조율하는 과정이 선행돼야 한다. 한국과 일본은 수술 성적이 매우 우수하고, 치료 패러다임이 여전히 수술 중심적이기 때문에, 고위험 진행성 위암에서 면역항암제 수술 전·후 보조요법의 역할을 정립하기 위해 외과 전문의와의 충분한 논의와 공감대 형성이 필수적이다. 환자가 최적의 치료 선택지를 놓치지 않도록 하기 위해서는 다학제적 협력이 무엇보다 중요하다. 종양내과의 관점에서는, 개별 환자에 맞춘 용량 조절과 적극적인 이상반응 관리가 핵심 과제다. 특히 FLOT은 강도가 높고 독성이 강하기 때문에, 항구토제, G-CSF 지원, 용량 조절 등 적극적인 지지요법을 통해 아시아 환자의 치료 완주를 돕는 전략이 필요하다. 또 하나의 큰 과제는 건강보험 급여다. 치료를 지속 가능한 급여 체계가 마련되지 않으면 임상 현장에서 실제 사용은 제한적일 수밖에 없다. 가장 큰 혜택이 기대되는 고위험 3기 환자에서 임상 경험과 실제 근거를 축적하는 작업이 필수적이며, 이는 환자 접근성 개선에 중요한 역할을 할 것이다.2025-12-15 06:00:46손형민 기자
"임핀지, 위암 보조요법서 면역항암제 활용 근거 제시"[데일리팜=손형민 기자] 수술이 가능한 위암·위식도접합부(GEJ) 선암에서도 약물 보조요법의 필요성이 대두되고 있다. 동아시아는 조기 진단과 수술 성적이 뛰어난 지역이지만, 2–3기 국소 진행성 환자군에서는 미세전이 잔존으로 인한 재발 위험이 여전히 남는다. 이런 맥락에서 수술 전과 수술 후에 항암제를 투여하는 전주기(Perioperative) 치료 전략이 치료 성과를 끌어올릴 수 있는 해법으로 부상해왔다. 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025'에서는 아스트라제네카의 면역항암제 '임핀지(더발루맙)'+표준 항암화학요법 FLOT(5-FU·류코보린·옥살리플라틴·도세탁셀) 병용요법의 가치를 확인한 MATTERHORN 임상3상 연구의 아시아인 하위분석이 소개됐다. 해당 임상에서 임핀지+FLOT은 글로벌 연구와 마찬가지로 위약+FLOT 대비 무사건생존(EFS)과 3년 전체생존율(OS), 병리학적 완전반응률(pCR) 개선까지 보고됐다. 이는 수술 가능한 위암에서 면역항암제의 역할이 앞단으로 이동하고 있다는 신호를 분명히 했다는 평가가 나온다. 위암 완치를 위한 치료의 근간은 여전히 수술이다. 그러나 아시아를 포함해 전 세계적으로 많은 위암 환자에서 수술 단독으로는 완치를 기대하기 어렵다는 인식이 확산되고 있다. MATTERHORN 연구는 수술 전에 면역항암제와 FLOT을 병용 투여하고, 근치적 절제술을 시행한 후 추가 치료를 이어가는 전략이 장기적인 치료 성과를 의미 있게 향상시킬 수 있음을 보여줬다. 해당 임상 결과를 토대로 미국 식품의약국(FDA)은 지난달 절제 가능한 위암·위식도접합부 선암 성인 환자에서 FLOT 병용 이후 임핀지 단독 유지요법을 승인했다. 이 같은 변화의 임상적 의미와 국내 적용 과제를 두고 MATTERHORN 연구 제1저자 엘레나 얀지기안 박사(미국 메모리얼 슬론 케터링 암센터 위장관종양내과 책임자)와, 연세암병원 종양내과 라선영 교수(대한암학회 이사장)를 ESMO ASIA 2025 현장에서 만나 이야기를 들었다. Q. MATTERHORN 임상 연구의 제1저자로서, 절제 가능한 위암 및 위식도접합부 선암 환자에서 수술 전·후 면역항암요법 전략을 추진한 배경이 궁금하다. 연구 결과 및 임상적 의의와 함께 설명 부탁드린다. 엘레나 얀지기안 박사: MATTERHORN 임상 연구는 절제 가능한 조기 단계 환자군에서 면역항암제-FLOT 병용을 통해 pCR, EFS, OS 모두에서 개선을 확인한 최초의 3상 임상 연구라는 점에서 큰 의의를 지닌다. 이번 학회에서는 일본, 한국, 대만 등 아시아 환자군을 대상으로 한 하위 분석 결과를 발표했는데, 아시아 환자에서도 글로벌 결과와 일관된 경향을 보였다. 이는 전주기 요법이 전 세계적으로 적용 가능함을 뒷받침한다. 최근 FDA가 절제 가능한 모든 위암 및 위식도접합부 선암에서 임핀지 수술 전·후 보조요법을 승인함에 따라, 지역 간 치료 전략을 조화시키는 것은 치료 분야 발전에 더욱 기여할 수 있을 것이다. 이는 매년 120만 명 이상이 위암으로 새롭게 진단되는 전 세계적인 질병 부담을 고려할 때 더욱 중요하다. Q. 아시아 환자에서도 글로벌 결과와 동일한 유효성과 안전성 경향이 확인됐다. 엘레나 얀지기안 박사: 이번 연구에서 가장 주목해야 할 점은 세 가지다. 첫번째는 지역 간 적용 가능성(feasibility across regions)이다. 임핀지 수술 전·후 보조요법은 아시아 의료기관에서도 충분히 투여 가능했으며, 의료진은 임핀지와 FLOT 모두 안전하게 투여할 수 있었다. 또 수술적 치료를 저해하지 않았다. 완전 절제(R0 resection) 비율과 수술 시행 가능성은 유지됐다. 여기에 주요 세 가지 유효성 지표인 pCR, EFS, OS가 동시에 개선됐다. 이는 위암 치료 환경에서 전례 없는 성과로, MATTEHRORN 임상 연구의 견고한 가치를 뒷받침한다. Q. 임핀지 수술 전·후 보조요법을 초기 단계 환자에게 적용할 때 의료진이 고려해야 할 점은 무엇인가? 엘레나 얀지기안 박사: 이번 연구에는 18세부터 84세까지 폭넓은 연령대의 환자가 참여했으며, 고령 환자에서도 젊은 환자와 유사한 치료 혜택이 확인됐다. 다만 일부 환자, 특히 아시아 환자에서는 영양 상태가 저하돼 있거나 백혈구 수치가 낮게 나타나는 경우가 있다. 아시아 연구진은 이러한 특성을 잘 이해하고 있으며, G-CSF의 조기 예방적 투여나 초기 FLOT의 초기 용량을 세심하게 조절하는 전략을 통해 안전성을 유지하며 치료 효과를 보존하는 데 도움이 될 수 있다. 무엇보다도 면밀한 임상 모니터링, 적절한 수액 요법, 체계적인 지지요법은 수술 전·후 치료를 성공적으로 완수하는 데 필수적 요소다. Q. 한국 의료진 사이에서는 임핀지 수술 전·후 보조요법이 2기보다 3기 또는 4기 위암 환자에 더 적합할 것이라는 의견도 있다. 이에 대한 견해가 궁금하다. 엘레나 얀지기안 박사: 위암의 임상 병기는 종종 부정확할 수 있다. 임상적으로 T2로 분류된 환자가 실제 수술에서는 T3 혹은 림프절 양성으로 확인되는 경우도 있다. 또한 광범위한 위 절제술 이후에는 많은 환자가 강도 높은 수술 후 보조요법을 견디기 어렵기 때문에 수술 전 보조요법의 가치가 더욱 높아진다. 면역항암제+FLOT 병용요법의 최대 효과가 종양이 아직 절제되지 않은 수술 전 치료에서 나타난다고 보고 있다. 이는 항종양 T세포의 활성화 및 확장이 최적으로 이뤄질 수 있기 때문이다. 실제로 수술 후 보조요법만 진행하는 것보다 수술 전 보조요법에서 더욱 높은 치료 혜택이 관찰된 것도 이를 뒷받침한다. 개인적으로는 임상 현장에서 T2로 추정되는 환자라도 하더라도, 미만성 또는 반지세포암 조직형을 가진 경우에는 특히 다학제적 논의를 통해 전·후 전신치료를 고려하고 있다. 더불어 아시아에서 종양 역학이 변화하며, 근위부와 위식도접합부 암이 증가하고 있다는 점도 중요하다. 이러한 종양은 전통적으로 수술 성적이 좋지 않았기 때문에, 종양 병기 하향을 목표로 한 접근의 필요성이 더욱 중요해지고 있다. Q. 초기 위암에서 비수술적 치료의 가능성을 어떻게 해석해야 하는가? 엘레나 얀지기안 박사: 이 분야는 여전히 매우 탐색적이며, 임상 연구 또는 전문 센터에서 극히 제한된 환자에게만 적용되고 있다. 일부 환자에서는 임상적·병리학적 완전반응을 달성하고, 고강도의 추적 관찰을 충실히 이행할 수 있는 경우에 한해 비수술 전략이 검토된 바 있다. 그러나 이는 표준 치료가 아니며, 특히 외과 의사들 사이에서는 여전히 논쟁이 많다. 그럼에도 이러한 논의는 완치를 목표로 하면서도 장기적인 삶의 질을 균형 있게 고려하려는 흐름의 확대를 반영한다. 위절제술은 최소 침습 수술이라 하더라도 식습관, 수면 패턴, 신체에 변화를 발생시킨다. 따라서 근거가 충분히 확보되고 엄격한 모니터링이 뒷받침되는 조건 하에 선택된 환자에서 위를 보존할 수 있다면, 이는 의미 있는 진전이 될 수 있다. 다만 이러한 접근이 널리 적용되기 위해서는 추가 연구가 반드시 필요하다. Q. 위암은 비교적 수술 성적이 양호한 것으로 알려져 있어 항암치료의 중요성이 상대적으로 덜 조명돼 왔다. 그럼에도 불구하고 MATTERHORN 연구는 수술 전·후 보조요법의 가치를 강조하고 있는데, 위암에서 이러한 치료 전략이 필요한 이유는 무엇인가? 라선영 교수: MATTERHORN 연구는 수술적 완치가 가능한 2기와 3기 진행성 위암 환자를 대상으로 진행됐다. 흔히 조기 위암(EGC)이라고 부르는 1기 위암은 내시경 절제 또는 위 절제술만으로 충분히 완치를 기대할 수 있는 단계로, 종양이 T1 병변인 점막과 점막하층에 국한된 위암을 의미한다. 반면, 2기와 3기 위암은 국소 진행성이며 재발 위험이 높다. 한국, 일본, 중국 등 동아시아에서는 국가 검진 체계와 숙련된 외과적 술기 덕분에 수술 후 보조항암요법만으로도 5년 생존율이 75~80%에 이른다. 그럼에도 불구하고 3기 환자의 약 30~40%에서는 재발을 경험하고 있어, 여전히 미충족 수요가 존재한다. 수술 전·후 보조요법은 수술 후에도 남아 있을 수 있는 미세전이를 제거하고, 이후 전신적 질병 조절을 지속하는 것을 목표로 한다. 미국과 유럽 등 서구에서는 비만 인구 증가, 위식도접합부 종양의 범위 차이 등을 고려해 종양 절제율을 높이기 위한 목적으로 이미 FLOT을 기반으로 한 수술 전·후 보조요법 치료 전략이 표준으로 자리잡았다. Q. MATTERHRON 연구의 핵심 결과는 무엇이며, 어떤 환자에서 의미가 있을지? 라선영 교수: MATTEHRORN 연구는 국소 진행성, 절제 가능한 위암 환자에게 새로운 치료 옵션을 제시했다는 점에서 의미가 크다. 특히 종양 부담이 큰 3기 고위험군에서 생존 혜택이 뚜렷하게 나타났다는 점이 주목할 만하다. 또한 전체생존율 곡선에서 5년 시점에 50%를 상회할 가능성이 높다는 점도 고무적이다. 다만 이번 연구는 한국과 일본이 오랜 기간 사용해온 수술 후 보조항암요법이 아니라, 글로벌 표준치료인 FLOT을 대조군으로 비교한 연구라는 점을 유념해야 한다. FLOT은 매우 효과적인 요법이지만, 상대적으로 높은 약물 강도로 인해 아시아 환자는 치료를 지속하는 데 어려움을 겪는 경우가 있다. 따라서 수술 결과가 좋은 아시아에서는 이 요법을 모든 2기와 3기 환자에게 일률적으로 적용하기보다 병기가 높고 재발 위험이 큰 환자군을 선별해 적용하는 것이 더 적절할 수 있다고 판단된다. Q. 국내에 임핀지 수술 전·후 보조요법이 도입된다면, 어떤 환자들이 가장 적절할지? 라선영 교수: MATTERHORN 연구가 장기 생존 데이터를 통해 3기 환자에서 무사건 생존율 및 전체생존율 등 지속적인 생존 이득을 확인한다면, 국내에서 3기 고위험 진행성 위암 환자를 중심으로 수술 전·후 보조요법을 우선적으로 고려할 가능성이 높다. 2기 환자의 경우 수술 후 보조항암요법만으로도 5년 생존율이 최대 80%에 이르기 때문에 임핀지 수술 전·후 보조요법이 제공할 수 있는 추가적인 이익과 높은 치료 비용 부담 및 독성 사이의 균형을 고려해야 한다. 실제로 MATTERHORN 연구에서도 수술 후 임핀지 보조요법을 완료한 환자는 40~50%에 불과했는데, 이는 특히 수술 후 FLOT 치료의 어려움을 반영하는 결과다. 미세전이 위험이 높고, 2년 내 30–40% 재발 위험을 가진 3기 환자가 가장 큰 혜택을 기대할 수 있다. 임상적으로는 광범위한 림프절 침범, T4 병기, 보다 공격적인 조직학적 아형 등 특성이 치료 결정에 중요한 기준이 될 수 있다. 앞으로는 바이오마커 기반 접근을 통해 치료 강도를 보다 세밀하게 조정하고, 불필요한 독성을 최소화하는 방향으로 발전할 것이라 생각한다. Q. MATTERHORN 연구에 참여한 아시아인 환자의 특징과 서양 환자와의 차이는 무엇인지 말씀 부탁드린다. 라선영 교수: MATTERHORN 연구에 참여한 아시아 환자의 특징 중 하나는 전반적으로 수행 능력이 좋고, 종양 부담이 비교적 낮았다는 점이다. 한국과 일본처럼 조기 진단율이 높고, 수술 성적이 우수한 국가에서는 임상 연구에 등록되는 환자들의 전반적인 컨디션이 서양 환자보다 더 양호할 가능성이 있다. 연구에서 4기 환자의 비중이 다소 높아 보일 수 있으나, 이는 절제가 불가능한 M1 전이성 환자를 의미하는 것이 아니라, 종양 침윤이 깊거나 림프절 전이가 광범위한 고위험 진행성 위암 환자로 해석하는 것이 적절하다. 이번 연구의 전체 등록 환자 중 아시아 환자는 약 20% 수준이었다. 따라서 향후 임핀지 전·후 보조요법을 실제 임상에서 적용하기 위해서는 아시아 환자 데이터를 더 축적하는 과정이 필요하다. Q. 한국에서 임핀지 수술 전·후 보조요법을 도입하기 위해서는 어떤 과제를 해결해야 한다고 보는가? 라선영 교수: 무엇보다 외과 전문의와 종양내과 전문의 간 치료 접근 방식을 조율하는 과정이 선행돼야 한다. 한국과 일본은 수술 성적이 매우 우수하고, 치료 패러다임이 여전히 수술 중심적이기 때문에, 고위험 진행성 위암에서 면역항암제 수술 전·후 보조요법의 역할을 정립하기 위해 외과 전문의와의 충분한 논의와 공감대 형성이 필수적이다. 환자가 최적의 치료 선택지를 놓치지 않도록 하기 위해서는 다학제적 협력이 무엇보다 중요하다. 종양내과의 관점에서는, 개별 환자에 맞춘 용량 조절과 적극적인 이상반응 관리가 핵심 과제다. 특히 FLOT은 강도가 높고 독성이 강하기 때문에, 항구토제, G-CSF 지원, 용량 조절 등 적극적인 지지요법을 통해 아시아 환자의 치료 완주를 돕는 전략이 필요하다. 또 하나의 큰 과제는 건강보험 급여다. 치료를 지속 가능한 급여 체계가 마련되지 않으면 임상 현장에서 실제 사용은 제한적일 수밖에 없다. 가장 큰 혜택이 기대되는 고위험 3기 환자에서 임상 경험과 실제 근거를 축적하는 작업이 필수적이며, 이는 환자 접근성 개선에 중요한 역할을 할 것이다.2025-12-15 06:00:46손형민 기자 -
 급여 결정에 RWE 활용 추진...내년 가이드라인 공표[데일리팜=정흥준 기자]약제 급여 등재와 등재 후 재평가에서 RWE(Real-World Evidence)를 활용하기 위한 가이드라인이 내년 발표될 예정이다. 건강보험심사평가원의 연구용역이 마무리 단계로 산업계 의견수렴을 거쳐 가이드라인을 공표할 계획이다. 다만, 실제로 약제 급여 결정에 활용하기 위해서는 RWD(Real-World Data)와 RWE의 신뢰도를 확보하는 중요 과제가 남아있다. 또 RWE 확보에 부담을 토로하는 제약사들의 반발도 예상된다. 12일 오후 심평원과 건보공단, 제약사 관계자들은 한국사회약학회 학술대회에서 급여 결정에 RWE 활용 방안을 놓고 열띤 토론을 벌였다. 이날 심평원은 마무리 단계에 있는 RWE 활용 연구용역을 정리해, 곧 가이드라인을 공표할 계획을 밝혔다. 강라원 심평원 약제성과평가운영부장은 “해외 주요 기관에서도 RWE를 활용하는 사례는 많다. 캐나다와 영국은 등재 시와 등재 이후 근거를 재평가하는 과정에서도 RWE가 실질적으로 의사결정의 근거로 주요하게 활용되고 있다”고 했다. 강라원 부장은 “현 시점의 과제는 RWD 수집부터 RWE 생성까지 신뢰를 어떻게 확보할 것이냐다. 연구를 통해 제외국 사례를 봤을 때 품질 관리를 위해 자국의 실정에 맞는 가이드라인을 활용하고 있다. 심평원도 RWE 가이드라인 개발 연구를 진행했고 연내 마무리되면, 이해당사자 의견을 수렴해 내년 가이드라인을 공표할 예정”이라고 밝혔다. 강 부장은 “등재 후 불확실성을 해소하기 위해 자료 수집과 근거 형성을 위해 적극적인 참여가 필요하다. 근거 생산이 마련될 수 있도록 협업이 잘 이뤄지길 바란다”고 제약업계를 향한 당부의 말도 전했다. RWE 활용은 경제성평가 생략 약제가 급증하는 현실 속에서 불확실성을 해소하기 위한 정부의 고민이 담겨있다는 설명이다. 오세림 건보공단 협상사후관리부장은 “일부 제약사의 책임도 있다. 경평을 할 수 있음에도 경평생략으로 많은 약제가 들어왔다. 작년과 올해 위험분담약제 중 절반이 경평생략으로 들어왔다”며 이로 인해 비용효과에 대한 불확실성이 커지고 있다고 했다. 오 부장은 “RWE 필요하다면 해야 한다. 다만 많은 돈이 들어가거나 자료 수집이 쉽지 않은 것도 사실이다. 예측가능성과 수용성이 떨어질 거 같아 우려되는 부분도 있다”면서 “필요하다면 법적 근거를 마련하고, 범정부적인 레지스트리를 마련하는 게 맞다”고 말했다. 또 공단이 실시하고 있는 성과기반 환급형 계약을 확대하고, 주기적으로 재평가하고 있는 성과 자료를 활용하는 것도 방법이 될 수 있다고 제안했다. 산업계 "RWD 데이터 표준화 안돼...해외 데이터도 인정을" 제약업계에서는 RWE 가이드라인이 자칫 임상시험 수준의 추가적 규제가 될 것을 우려하고 있다. 또 RWD 표준화도 이뤄지지 않은 상황에서 RWE 확보를 위한 업계 부담이 크다고 호소했다. 해외 RWE 데이터라도 인정해달라는 의견이다. 나정현 한국다이이찌산쿄 상무는 “우선 적용 대상이 어디까지인지가 명확해져야 한다. 또 현장에서는 데이터가 제각각이다. 표준화가 이뤄지지 않은 상태에서 회사는 부담을 가질 수밖에 없다”며 공공 플랫폼 등 인프라 구축이 선행돼야 한다고 말했다. 아울러 RWE가 급여와 약가 결정에 어떻게 반영될지 예측이 가능하지 않으면, 기업의 입장에서는 투자 리스크가 크다고 호소했다. 안종련 한국얀센 전무는 “경평생략 제도로 들어오는 약제들은 비용효과성을 검토하지는 않지만 거의 최저가로 들어오는 상황이다. 총액제한까지 걸려있다”며 과도한 비용에 대한 장치는 이미 마련돼 있다는 설명했다. 희귀중증질환 치료제는 환자 수가 작아 국내 데이터만으로는 확보가 어렵다는 문제도 언급했다. 안 전무는 “외국에서 허가를 받거나 급여를 받거나 하는 과정에서 글로벌 RWE 데이터가 있다면 유연하게 수용해달라”고 요구했다. 이어 “가이드라인을 지나치게 세세하게 규정하거나 엄격하게 만들면 아무런 결정을 못 내리는 상황을 초래할 수 있다”며 유연한 가이드라인이 돼야 한다고 주장했다.2025-12-13 06:00:59정흥준 기자
급여 결정에 RWE 활용 추진...내년 가이드라인 공표[데일리팜=정흥준 기자]약제 급여 등재와 등재 후 재평가에서 RWE(Real-World Evidence)를 활용하기 위한 가이드라인이 내년 발표될 예정이다. 건강보험심사평가원의 연구용역이 마무리 단계로 산업계 의견수렴을 거쳐 가이드라인을 공표할 계획이다. 다만, 실제로 약제 급여 결정에 활용하기 위해서는 RWD(Real-World Data)와 RWE의 신뢰도를 확보하는 중요 과제가 남아있다. 또 RWE 확보에 부담을 토로하는 제약사들의 반발도 예상된다. 12일 오후 심평원과 건보공단, 제약사 관계자들은 한국사회약학회 학술대회에서 급여 결정에 RWE 활용 방안을 놓고 열띤 토론을 벌였다. 이날 심평원은 마무리 단계에 있는 RWE 활용 연구용역을 정리해, 곧 가이드라인을 공표할 계획을 밝혔다. 강라원 심평원 약제성과평가운영부장은 “해외 주요 기관에서도 RWE를 활용하는 사례는 많다. 캐나다와 영국은 등재 시와 등재 이후 근거를 재평가하는 과정에서도 RWE가 실질적으로 의사결정의 근거로 주요하게 활용되고 있다”고 했다. 강라원 부장은 “현 시점의 과제는 RWD 수집부터 RWE 생성까지 신뢰를 어떻게 확보할 것이냐다. 연구를 통해 제외국 사례를 봤을 때 품질 관리를 위해 자국의 실정에 맞는 가이드라인을 활용하고 있다. 심평원도 RWE 가이드라인 개발 연구를 진행했고 연내 마무리되면, 이해당사자 의견을 수렴해 내년 가이드라인을 공표할 예정”이라고 밝혔다. 강 부장은 “등재 후 불확실성을 해소하기 위해 자료 수집과 근거 형성을 위해 적극적인 참여가 필요하다. 근거 생산이 마련될 수 있도록 협업이 잘 이뤄지길 바란다”고 제약업계를 향한 당부의 말도 전했다. RWE 활용은 경제성평가 생략 약제가 급증하는 현실 속에서 불확실성을 해소하기 위한 정부의 고민이 담겨있다는 설명이다. 오세림 건보공단 협상사후관리부장은 “일부 제약사의 책임도 있다. 경평을 할 수 있음에도 경평생략으로 많은 약제가 들어왔다. 작년과 올해 위험분담약제 중 절반이 경평생략으로 들어왔다”며 이로 인해 비용효과에 대한 불확실성이 커지고 있다고 했다. 오 부장은 “RWE 필요하다면 해야 한다. 다만 많은 돈이 들어가거나 자료 수집이 쉽지 않은 것도 사실이다. 예측가능성과 수용성이 떨어질 거 같아 우려되는 부분도 있다”면서 “필요하다면 법적 근거를 마련하고, 범정부적인 레지스트리를 마련하는 게 맞다”고 말했다. 또 공단이 실시하고 있는 성과기반 환급형 계약을 확대하고, 주기적으로 재평가하고 있는 성과 자료를 활용하는 것도 방법이 될 수 있다고 제안했다. 산업계 "RWD 데이터 표준화 안돼...해외 데이터도 인정을" 제약업계에서는 RWE 가이드라인이 자칫 임상시험 수준의 추가적 규제가 될 것을 우려하고 있다. 또 RWD 표준화도 이뤄지지 않은 상황에서 RWE 확보를 위한 업계 부담이 크다고 호소했다. 해외 RWE 데이터라도 인정해달라는 의견이다. 나정현 한국다이이찌산쿄 상무는 “우선 적용 대상이 어디까지인지가 명확해져야 한다. 또 현장에서는 데이터가 제각각이다. 표준화가 이뤄지지 않은 상태에서 회사는 부담을 가질 수밖에 없다”며 공공 플랫폼 등 인프라 구축이 선행돼야 한다고 말했다. 아울러 RWE가 급여와 약가 결정에 어떻게 반영될지 예측이 가능하지 않으면, 기업의 입장에서는 투자 리스크가 크다고 호소했다. 안종련 한국얀센 전무는 “경평생략 제도로 들어오는 약제들은 비용효과성을 검토하지는 않지만 거의 최저가로 들어오는 상황이다. 총액제한까지 걸려있다”며 과도한 비용에 대한 장치는 이미 마련돼 있다는 설명했다. 희귀중증질환 치료제는 환자 수가 작아 국내 데이터만으로는 확보가 어렵다는 문제도 언급했다. 안 전무는 “외국에서 허가를 받거나 급여를 받거나 하는 과정에서 글로벌 RWE 데이터가 있다면 유연하게 수용해달라”고 요구했다. 이어 “가이드라인을 지나치게 세세하게 규정하거나 엄격하게 만들면 아무런 결정을 못 내리는 상황을 초래할 수 있다”며 유연한 가이드라인이 돼야 한다고 주장했다.2025-12-13 06:00:59정흥준 기자 -
 진행성 고형암서 효과 입증...'키트루다' 보조요법 잇단 성과[데일리팜=손형민 기자] 수술 전후(Perioperative) 보조요법에서 면역항암제 키트루다의 존재감이 빠르게 확대되고 있다. 13일 관련 업계에 따르면 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회(ESMO ASIA 2025)에서 '키트루다(펨브롤리주맙)'의 폐암 수술 전후 보조요법의 아시아인 하위분석이 공개됐다. 키트루다는 앞서 3상 KEYNOTE-671 연구를 통해 절제 가능한 초기 단계 비소세포폐암(NSCLC)에서 수술 전후 보조요법으로서의 유효성을 입증한 바 있다. 이번 ESMO ASIA 2025에서는 해당 연구의 5년 추적 결과를 토대로, 무사건생존(EFS)과 전체생존(OS) 지표가 아시아인 환자에서도 의미 있게 개선됐다는 점이 구체적으로 제시됐다. KEYNOTE-671은 절제 가능한 2~3B(N2)기 비소세소폐암 환자를 대상으로 설계됐다. 환자들은 수술 전 키트루다 200mg과 항암화학요법을 3주 간격으로 4주기 병용한 뒤 수술을 시행했고, 이후 수술 후 보조요법으로 키트루다 또는 위약을 최대 13주기(약 9개월)까지 투여받았다. 주요 평가변수는 EFS와 OS였다. 약 5년 추적시점(데이터 컷오프 시점 2025년 7월 3일)에서 키트루다군의 5년 무사건생존(EFS) 비율은 49.9%로 대조군 26.5% 대비 크게 높았다. 5년 OS 비율도 64.6%로 대조군 53.6%보다 우월했다. 병기와 PD-L1 발현 수준에 관계없이 전반적으로 유사한 경향이 확인됐으며, 이번 ESMO ASIA 2025에서는 아시아 등록 환자군에서도 OS 이점이 관찰됐다는 점이 함께 제시되면서 실제 아시아 진료 현장 적용 가능성을 뒷받침했다. 키트루다 투여군은 병기나 PD-L1 발현 수준에 관계없이 전반적으로 일관된 개선 효과가 확인됐으며, 아시아 등록 환자군에서도 OS 이점이 유지됐다는 점이 이번 학술대회에서 함께 보고됐다. 연구진은 "폐암에서 수술 전후 면역항암 보조요법이 단기 재발 억제를 넘어 장기 생존으로 이어진다는 점을 아시아 데이터로 다시 확인했다"고 평가했다. 방광암·두경부암 보조요법 허가 확대…'수술 중심 치료'에 면역항암제 결합 폐암에서 축적된 근거를 바탕으로, 키트루다는 두경부암과 방광암에서도 수술을 전제로 한 보조요법 전략을 확대하고 있다. 단순히 전이·재발 단계 치료제에 머물던 면역항암제가 조기 단계로 이동하며, 규제기관 허가까지 이어지고 있다는 점에서 의미가 크다. 두경부암에서는 최근 키트루다가 절제 가능한 국소 진행성 두경부 편평상피세포암 환자의 수술 전후 보조요법으로 국내 허가를 획득했다. 허가 근거는 3·4A기 환자를 대상으로 한 3상 KEYNOTE-689 연구다. 이 연구에서 환자들은 수술 전 키트루다 단독요법을 2주기 투여받은 뒤 수술을 시행했고, 수술 후에는 키트루다와 방사선요법을 병용(고위험군에서는 시스플라틴 추가)한 뒤 키트루다 단독 유지요법을 받았다. 중앙값 38.3개월 추적 결과, PD-L1 양성(CPS 1 이상) 환자군에서 질병 진행·재발·사망 위험이 30% 감소했고, EFS 중앙값은 59.7개월로 대조군 29.6개월 대비 2배 이상 연장됐다. 수술과 방사선치료만으로는 재발 위험이 높았던 환자군에서 보조요법의 임상적 가치를 입증했다는 평가다. 방광암에서는 면역항암제+항체약물접합체(ADC) 병용 전략이 수술 전후 보조요법으로 승인됐다. 최근 미국 식품의약국(FDA)은 키트루다+파드셉(엔포투맙베도틴) 병용요법을 시스플라틴 기반 화학요법이 불가능한 근육침습성 방광암(MIBC) 성인 환자의 수술 전 선행요법 및 방광절제술 후 보조요법으로 승인했다. 근거가 된 임상3상 KEYNOTE-905(EV-303) 연구에서 키트루다+파드셉 병용 수술 전후 치료는 수술 단독 대비 EFS 위험을 60% 낮췄고 OS도 50% 개선했다. 병리학적 완전관해율(pCR) 역시 57.1%로 수술 단독군 8.6% 대비 압도적인 차이를 보였다. 제약업계는 폐암·두경부암·방광암에서 공통적으로 확인되는 흐름에 주목하고 있다. 수술이 가능한 단계에서 면역항암제를 앞뒤로 배치해 미세 잔존암과 잠재적 미세전이를 조기에 억제함으로써 재발을 줄이고 장기 생존을 노리는 전략이 현실화되고 있다는 것이다. 한 업계 관계자는 "전이·재발 단계에서 효과를 입증한 면역항암제가 이제는 수술 중심 치료의 성과를 끌어올리는 핵심 축으로 이동하고 있다"며 "향후 급여 확대와 실제 임상 적용 범위가 관건이 될 것"이라고 말했다.2025-12-13 06:00:55손형민 기자
진행성 고형암서 효과 입증...'키트루다' 보조요법 잇단 성과[데일리팜=손형민 기자] 수술 전후(Perioperative) 보조요법에서 면역항암제 키트루다의 존재감이 빠르게 확대되고 있다. 13일 관련 업계에 따르면 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회(ESMO ASIA 2025)에서 '키트루다(펨브롤리주맙)'의 폐암 수술 전후 보조요법의 아시아인 하위분석이 공개됐다. 키트루다는 앞서 3상 KEYNOTE-671 연구를 통해 절제 가능한 초기 단계 비소세포폐암(NSCLC)에서 수술 전후 보조요법으로서의 유효성을 입증한 바 있다. 이번 ESMO ASIA 2025에서는 해당 연구의 5년 추적 결과를 토대로, 무사건생존(EFS)과 전체생존(OS) 지표가 아시아인 환자에서도 의미 있게 개선됐다는 점이 구체적으로 제시됐다. KEYNOTE-671은 절제 가능한 2~3B(N2)기 비소세소폐암 환자를 대상으로 설계됐다. 환자들은 수술 전 키트루다 200mg과 항암화학요법을 3주 간격으로 4주기 병용한 뒤 수술을 시행했고, 이후 수술 후 보조요법으로 키트루다 또는 위약을 최대 13주기(약 9개월)까지 투여받았다. 주요 평가변수는 EFS와 OS였다. 약 5년 추적시점(데이터 컷오프 시점 2025년 7월 3일)에서 키트루다군의 5년 무사건생존(EFS) 비율은 49.9%로 대조군 26.5% 대비 크게 높았다. 5년 OS 비율도 64.6%로 대조군 53.6%보다 우월했다. 병기와 PD-L1 발현 수준에 관계없이 전반적으로 유사한 경향이 확인됐으며, 이번 ESMO ASIA 2025에서는 아시아 등록 환자군에서도 OS 이점이 관찰됐다는 점이 함께 제시되면서 실제 아시아 진료 현장 적용 가능성을 뒷받침했다. 키트루다 투여군은 병기나 PD-L1 발현 수준에 관계없이 전반적으로 일관된 개선 효과가 확인됐으며, 아시아 등록 환자군에서도 OS 이점이 유지됐다는 점이 이번 학술대회에서 함께 보고됐다. 연구진은 "폐암에서 수술 전후 면역항암 보조요법이 단기 재발 억제를 넘어 장기 생존으로 이어진다는 점을 아시아 데이터로 다시 확인했다"고 평가했다. 방광암·두경부암 보조요법 허가 확대…'수술 중심 치료'에 면역항암제 결합 폐암에서 축적된 근거를 바탕으로, 키트루다는 두경부암과 방광암에서도 수술을 전제로 한 보조요법 전략을 확대하고 있다. 단순히 전이·재발 단계 치료제에 머물던 면역항암제가 조기 단계로 이동하며, 규제기관 허가까지 이어지고 있다는 점에서 의미가 크다. 두경부암에서는 최근 키트루다가 절제 가능한 국소 진행성 두경부 편평상피세포암 환자의 수술 전후 보조요법으로 국내 허가를 획득했다. 허가 근거는 3·4A기 환자를 대상으로 한 3상 KEYNOTE-689 연구다. 이 연구에서 환자들은 수술 전 키트루다 단독요법을 2주기 투여받은 뒤 수술을 시행했고, 수술 후에는 키트루다와 방사선요법을 병용(고위험군에서는 시스플라틴 추가)한 뒤 키트루다 단독 유지요법을 받았다. 중앙값 38.3개월 추적 결과, PD-L1 양성(CPS 1 이상) 환자군에서 질병 진행·재발·사망 위험이 30% 감소했고, EFS 중앙값은 59.7개월로 대조군 29.6개월 대비 2배 이상 연장됐다. 수술과 방사선치료만으로는 재발 위험이 높았던 환자군에서 보조요법의 임상적 가치를 입증했다는 평가다. 방광암에서는 면역항암제+항체약물접합체(ADC) 병용 전략이 수술 전후 보조요법으로 승인됐다. 최근 미국 식품의약국(FDA)은 키트루다+파드셉(엔포투맙베도틴) 병용요법을 시스플라틴 기반 화학요법이 불가능한 근육침습성 방광암(MIBC) 성인 환자의 수술 전 선행요법 및 방광절제술 후 보조요법으로 승인했다. 근거가 된 임상3상 KEYNOTE-905(EV-303) 연구에서 키트루다+파드셉 병용 수술 전후 치료는 수술 단독 대비 EFS 위험을 60% 낮췄고 OS도 50% 개선했다. 병리학적 완전관해율(pCR) 역시 57.1%로 수술 단독군 8.6% 대비 압도적인 차이를 보였다. 제약업계는 폐암·두경부암·방광암에서 공통적으로 확인되는 흐름에 주목하고 있다. 수술이 가능한 단계에서 면역항암제를 앞뒤로 배치해 미세 잔존암과 잠재적 미세전이를 조기에 억제함으로써 재발을 줄이고 장기 생존을 노리는 전략이 현실화되고 있다는 것이다. 한 업계 관계자는 "전이·재발 단계에서 효과를 입증한 면역항암제가 이제는 수술 중심 치료의 성과를 끌어올리는 핵심 축으로 이동하고 있다"며 "향후 급여 확대와 실제 임상 적용 범위가 관건이 될 것"이라고 말했다.2025-12-13 06:00:55손형민 기자 -
 "필수약 품절 해소, 정부 투자·약가우대 없이는 한계"[데일리팜=정흥준 기자]필수의약품 공급 부족 문제를 해소하기 위해서는 정부의 재정 투자, 약가우대 등의 정책이 뒷받침돼야 한다는 조언이 나왔다. 또 민간에만 의존할 것이 아니라 공공 제조 인프라를 구축하고, 해외 의존이 불가피한 영역에서는 적극적인 연대 체계를 마련해야 한다는 제언이다. 12일 박실비아 한국보건사회연구원 연구위원은 한국사회약학회 학술대회에서 의약품 공급 안정성 제고를 위한 정책 지원의 필요성을 강조했다. 코로나 이후 미국과 유럽 등도 의약품 공급 문제를 해결하기 위한 대응책을 마련하고 있다는 설명이다. 미국은 행정명령을 통해 미국 내 제조를 늘리고, 국내 공급망에서 여분이 있도록 조치하고 있다. 국내 생산 확대를 위해 금융지원 인센티브를 제공하고, 우수 제조자가 혜택을 받는 평가시스템을 구축했다. 올해에는 자국 내 의약품 제조시설 설립과 제조 승인 기간 단축을 목표로 규제 장벽을 낮추고 있다. 유럽도 제조 역량 강화를 위한 전략적 프로젝트를 추진하고 있다. 또 허가권자에 대한 공급 계획과 보고 의무를 강화하고, 필수약 접근성 격차 해소를 위해 회원국 공동구매를 확대했다. 박 위원은 한국도 의약품 공급 중단과 부족 보고건수가 증가하는 추세라며 대응책 마련의 필요성을 강조했다. 박 위원은 “필수약 제조·공급망 강화는 기업의 의지만으로는 달성에 한계가 있다. 제조기술 개발과 시설 설립을 위해 보조금과 지원금, 저금리 대출, 투자, 조세감면 등의 재정지원이 필요하다”고 말했다. 이어 “국가필수약 중심으로 중점 지원·관리 대상 의약품을 식별할 필요가 있다. 우선순위를 부여해 전략을 도출해야 한다. 또 제조사의 공급위험관리계획 수립과 이행을 관리해야 한다”고 제안했다. 또 박 위원은 “원료 포함 필수약 국내 제조 유지에 대한 약가 우대가 필요하다. 전략적으로 제조 국산화, 다변화가 추진된 필수약에 대해서는 공공구매 시 우대해야 한다”고 주장했다. 끝으로 박 위원은 “민간 제약사의 실행에 의존해 모든 필수약을 공급하는 건 한계가 있다. 공공 중심의 의약품 제조 인프라 구축도 필요하다”며 “또 글로벌 공급망에 의존이 불가피한 영역에서는 적극적인 협력과 연대 체계가 필요하다”며 공적 역할의 중요성을 설명했다.2025-12-12 12:07:58정흥준 기자
"필수약 품절 해소, 정부 투자·약가우대 없이는 한계"[데일리팜=정흥준 기자]필수의약품 공급 부족 문제를 해소하기 위해서는 정부의 재정 투자, 약가우대 등의 정책이 뒷받침돼야 한다는 조언이 나왔다. 또 민간에만 의존할 것이 아니라 공공 제조 인프라를 구축하고, 해외 의존이 불가피한 영역에서는 적극적인 연대 체계를 마련해야 한다는 제언이다. 12일 박실비아 한국보건사회연구원 연구위원은 한국사회약학회 학술대회에서 의약품 공급 안정성 제고를 위한 정책 지원의 필요성을 강조했다. 코로나 이후 미국과 유럽 등도 의약품 공급 문제를 해결하기 위한 대응책을 마련하고 있다는 설명이다. 미국은 행정명령을 통해 미국 내 제조를 늘리고, 국내 공급망에서 여분이 있도록 조치하고 있다. 국내 생산 확대를 위해 금융지원 인센티브를 제공하고, 우수 제조자가 혜택을 받는 평가시스템을 구축했다. 올해에는 자국 내 의약품 제조시설 설립과 제조 승인 기간 단축을 목표로 규제 장벽을 낮추고 있다. 유럽도 제조 역량 강화를 위한 전략적 프로젝트를 추진하고 있다. 또 허가권자에 대한 공급 계획과 보고 의무를 강화하고, 필수약 접근성 격차 해소를 위해 회원국 공동구매를 확대했다. 박 위원은 한국도 의약품 공급 중단과 부족 보고건수가 증가하는 추세라며 대응책 마련의 필요성을 강조했다. 박 위원은 “필수약 제조·공급망 강화는 기업의 의지만으로는 달성에 한계가 있다. 제조기술 개발과 시설 설립을 위해 보조금과 지원금, 저금리 대출, 투자, 조세감면 등의 재정지원이 필요하다”고 말했다. 이어 “국가필수약 중심으로 중점 지원·관리 대상 의약품을 식별할 필요가 있다. 우선순위를 부여해 전략을 도출해야 한다. 또 제조사의 공급위험관리계획 수립과 이행을 관리해야 한다”고 제안했다. 또 박 위원은 “원료 포함 필수약 국내 제조 유지에 대한 약가 우대가 필요하다. 전략적으로 제조 국산화, 다변화가 추진된 필수약에 대해서는 공공구매 시 우대해야 한다”고 주장했다. 끝으로 박 위원은 “민간 제약사의 실행에 의존해 모든 필수약을 공급하는 건 한계가 있다. 공공 중심의 의약품 제조 인프라 구축도 필요하다”며 “또 글로벌 공급망에 의존이 불가피한 영역에서는 적극적인 협력과 연대 체계가 필요하다”며 공적 역할의 중요성을 설명했다.2025-12-12 12:07:58정흥준 기자 -
 AZ "아시아 기반 근거 확대…주요 고형암 치료옵션 확장"[싱가포르=손형민 기자] 아스트라제네카가 아시아에서 축적되는 임상 근거와 연구 네트워크의 중요성을 강조하며, 주요 고형암 영역에서 새로운 치료 옵션을 제시했다. 특히 이 회사는 2030년까지 자사 치료제가 간암 환자 3명 중 1명, 담도암 환자 3명 중 1명, 위암 환자의 7명 중 1명에게 투여되는 것을 목표로 하고 있으며, 이를 가능하게 하는 핵심 동력이 바로 아시아라고 피력했다. 실제 소화기암 임상시험 참여 환자의 60~70%가 아시아에서 모집되고 있고, 이 지역 곳곳에 약 50개 연구 사이트가 운영되면서 글로벌 개발의 중심 역할을 하고 있다는 게 아스트라제네카의 설명이다. 유방암·폐암·GI암 핵심 데이터 공개…"아시아 환자에서 생존 개선 일관" 10일 관련 업계에 따르면 아스트라제네카는 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025' 현장에서 미디어 브리핑을 개최했다. 이 자리에서 아스트라제네카 글로벌 본사 주요 임직원들은 아시아가 단순한 참여 지역을 넘어 신약 개발·임상 근거·조기 진단 기술의 중심축으로 부상하고 있다고 입을 모았다. 특히 이들은 폐암·유방암·위장관암 등 아시아에서 발병률이 높고 임상적 미충족 수요가 큰 암종을 중심으로, 이번 학회에서 공개된 연구들이 "향후 글로벌 표준치료 변화를 견인할 근거가 될 것"이라고 강조했다. 아스트라제네카는 이번 브리핑에서 HER2 양성 유방암·삼중음성유방암, EGFR 변이 폐암, 조기 위암·간암·담도암 등 주요 암종에서 발표된 최신 데이터를 요약해 공유했다. 먼저 유방암에서는 ▲HER2 양성 전이성 유방암 1차 치료에서 '엔허투(트라스투주맙데룩스테칸)+퍼제타(퍼투주맙)'의 1차 치료제로서의 가능성 ▲엔허투의 수술 전 보조요법 ▲PD-L1 음성 TNBC 환자에서 '다트로웨이(다토포타맙)'의 생존 개선 효과가 소개됐다. 아시아 환자군에서 글로벌과 동일한 효과가 확인됐다는 점이 강조됐다. 실비아 바렐라 아스트라제네카 부사장은 "HER2 양성 전이성 유방암에서 엔허투 기반 병용요법이 기존 표준요법의 한계를 넘어서는 가능성을 보였고, 면역항암제 적용이 어려운 삼중음성유방암 1차 치료에서는 다트로웨이가 생존 개선을 보였다. 유방암에서 ADC 중심의 치료 전환이 본격화되고 있다"고 설명했다. 폐암에서는 EGFR 변이가 특히 많은 아시아 환자 특성에 맞춘 임상 데이터가 공개됐다. 마크 심스 아스트라제네카 부사장은 수술 전 타그리소 신보조요법의 임상 연구 'NeoADAURA'에서 환자 삶의 질 유지가 확인됐고, 타그리소+화학요법 병용의 임상 연구 'FLAURA2'의 전체생존기간(OS) 중앙값이 4년을 달성했다는 점을 언급했다. 마크 부사장은 "조기 병기부터 전이성까지 치료 개입 시점을 앞당기는 전략이 아시아 환자에서도 확실한 성과를 내고 있다. 또 MET 내성 기전을 겨냥한 사볼리티닙 병용 전략에서도 아시아 하위분석에서 일관된 PFS 개선이 보고됐다"고 평가했다. 위암·간암·담도암 등 주요 소화기암 분야에서도 면역항암제 '임핀지(더발루맙)'의 긍정적인 데이터가 발표됐다. ▲조기 위암에서 면역항암제 병용이 새로운 치료 축을 만든 MATTERHORN, ▲미충족 수요가 높안 간세포암 환자의 치료 혜택을 확인한 SIERRA, ▲임핀지+젬시타빈 병용요법의 추가 가능성을 확인한 TOURMALINE 연구 등이 대표적이다. 케이티 밀러 아스트라제네카 부사장은 "ESMO Asia에서 GI 관련 연구들은 총 네 건이 구두발표로 채택됐다. 이는 종양학 커뮤니티가 이 질환군에 대해 얼마나 높은 관심을 가지고 있는지, 그리고 아시아 지역에서 이들 질환이 얼마나 중요한지를 잘 보여준다"라고 강조했다. 차세대 플랫폼·정밀의학·병용요법 전략 강화 아스트라제네카는 아시아가 암 부담이 높은 지역인 만큼, 차세대 항암 플랫폼 개발의 중심도 이 지역이 될 것이라고 밝혔다. 특히 ▲차세대 ADC(HER2·CLDN18.2), ▲TIGIT 기반 이중항체 rilvegostemab, ▲GPC3 CAR-T 및 T-cell engager, ▲차세대 PARP·PRMT5 억제제, ▲EGFR·MET 표적 방사선결합체 등 다중 기전 파이프라인을 소개하며 '조기 병기 개입, 정밀 타깃 전략, 내성 극복을 위한 새 병용 가능성 제시'등을 핵심 방향으로 제시했다. 특히 아스트라제네카는 이번 발표를 통해 아시아가 앞으로의 글로벌 항암 생태계에서 결정적 역할을 할 것이라는 점을 분명히 했다. 임상 환자의 60~70%가 아시아에서 모집되고, 대다수 연구가 아시아 데이터 기반으로 구성되는 만큼, 향후 신약 허가·급여 논의에도 아시아 중심의 근거 반영이 더욱 중요해질 것으로 전망된다 오사마 라마 아스트라제네카 부사장은 "효과적인 치료를 질병의 더 초기 단계로 이동시키는 것을 목표로 하고 있다. 더 이른 시점에 개입할수록 더 많은 환자를 완치에 가깝게 이끌 수 있기 때문"이라며 "소화기암 임상시험에 참여하는 환자의 60~70%가 아시아에서 모집되고 있으며, 이 지역 곳곳에 약 50개의 활성 임상시험 사이트가 운영 중이다. 아시아 전역의 연구자와 임상의 여러분의 긴밀한 협력을 이어나갈 것"이라고 전했다. 실비아 부사장은 "아시아 암환자들의 비율은 지속 늘어나고 있다. 특히 인구 증가, 고령화, 산업화, 환경·직업성 발암물질 노출 증가, 생활습관 변화로 인해 아시아의 암 부담은 더욱 늘어날 것으로 예상된다"라며 "아스트라제네카는 2030년까지 20개의 신약 출시를 목표로 하고 있으며, 이 중 절반이 암 분야 신약이다. 우리의 비전은 치료 혁신을 통해 암을 사망 원인에서 제거하고, 진단·치료·조기 발견 접근성을 높여 의료 형평성을 실현하는 것"이라고 피력했다.2025-12-10 12:03:53손형민 기자
AZ "아시아 기반 근거 확대…주요 고형암 치료옵션 확장"[싱가포르=손형민 기자] 아스트라제네카가 아시아에서 축적되는 임상 근거와 연구 네트워크의 중요성을 강조하며, 주요 고형암 영역에서 새로운 치료 옵션을 제시했다. 특히 이 회사는 2030년까지 자사 치료제가 간암 환자 3명 중 1명, 담도암 환자 3명 중 1명, 위암 환자의 7명 중 1명에게 투여되는 것을 목표로 하고 있으며, 이를 가능하게 하는 핵심 동력이 바로 아시아라고 피력했다. 실제 소화기암 임상시험 참여 환자의 60~70%가 아시아에서 모집되고 있고, 이 지역 곳곳에 약 50개 연구 사이트가 운영되면서 글로벌 개발의 중심 역할을 하고 있다는 게 아스트라제네카의 설명이다. 유방암·폐암·GI암 핵심 데이터 공개…"아시아 환자에서 생존 개선 일관" 10일 관련 업계에 따르면 아스트라제네카는 최근 싱가포르에서 열린 유럽종양학회 아시아 학술대회 'ESMO ASIA 2025' 현장에서 미디어 브리핑을 개최했다. 이 자리에서 아스트라제네카 글로벌 본사 주요 임직원들은 아시아가 단순한 참여 지역을 넘어 신약 개발·임상 근거·조기 진단 기술의 중심축으로 부상하고 있다고 입을 모았다. 특히 이들은 폐암·유방암·위장관암 등 아시아에서 발병률이 높고 임상적 미충족 수요가 큰 암종을 중심으로, 이번 학회에서 공개된 연구들이 "향후 글로벌 표준치료 변화를 견인할 근거가 될 것"이라고 강조했다. 아스트라제네카는 이번 브리핑에서 HER2 양성 유방암·삼중음성유방암, EGFR 변이 폐암, 조기 위암·간암·담도암 등 주요 암종에서 발표된 최신 데이터를 요약해 공유했다. 먼저 유방암에서는 ▲HER2 양성 전이성 유방암 1차 치료에서 '엔허투(트라스투주맙데룩스테칸)+퍼제타(퍼투주맙)'의 1차 치료제로서의 가능성 ▲엔허투의 수술 전 보조요법 ▲PD-L1 음성 TNBC 환자에서 '다트로웨이(다토포타맙)'의 생존 개선 효과가 소개됐다. 아시아 환자군에서 글로벌과 동일한 효과가 확인됐다는 점이 강조됐다. 실비아 바렐라 아스트라제네카 부사장은 "HER2 양성 전이성 유방암에서 엔허투 기반 병용요법이 기존 표준요법의 한계를 넘어서는 가능성을 보였고, 면역항암제 적용이 어려운 삼중음성유방암 1차 치료에서는 다트로웨이가 생존 개선을 보였다. 유방암에서 ADC 중심의 치료 전환이 본격화되고 있다"고 설명했다. 폐암에서는 EGFR 변이가 특히 많은 아시아 환자 특성에 맞춘 임상 데이터가 공개됐다. 마크 심스 아스트라제네카 부사장은 수술 전 타그리소 신보조요법의 임상 연구 'NeoADAURA'에서 환자 삶의 질 유지가 확인됐고, 타그리소+화학요법 병용의 임상 연구 'FLAURA2'의 전체생존기간(OS) 중앙값이 4년을 달성했다는 점을 언급했다. 마크 부사장은 "조기 병기부터 전이성까지 치료 개입 시점을 앞당기는 전략이 아시아 환자에서도 확실한 성과를 내고 있다. 또 MET 내성 기전을 겨냥한 사볼리티닙 병용 전략에서도 아시아 하위분석에서 일관된 PFS 개선이 보고됐다"고 평가했다. 위암·간암·담도암 등 주요 소화기암 분야에서도 면역항암제 '임핀지(더발루맙)'의 긍정적인 데이터가 발표됐다. ▲조기 위암에서 면역항암제 병용이 새로운 치료 축을 만든 MATTERHORN, ▲미충족 수요가 높안 간세포암 환자의 치료 혜택을 확인한 SIERRA, ▲임핀지+젬시타빈 병용요법의 추가 가능성을 확인한 TOURMALINE 연구 등이 대표적이다. 케이티 밀러 아스트라제네카 부사장은 "ESMO Asia에서 GI 관련 연구들은 총 네 건이 구두발표로 채택됐다. 이는 종양학 커뮤니티가 이 질환군에 대해 얼마나 높은 관심을 가지고 있는지, 그리고 아시아 지역에서 이들 질환이 얼마나 중요한지를 잘 보여준다"라고 강조했다. 차세대 플랫폼·정밀의학·병용요법 전략 강화 아스트라제네카는 아시아가 암 부담이 높은 지역인 만큼, 차세대 항암 플랫폼 개발의 중심도 이 지역이 될 것이라고 밝혔다. 특히 ▲차세대 ADC(HER2·CLDN18.2), ▲TIGIT 기반 이중항체 rilvegostemab, ▲GPC3 CAR-T 및 T-cell engager, ▲차세대 PARP·PRMT5 억제제, ▲EGFR·MET 표적 방사선결합체 등 다중 기전 파이프라인을 소개하며 '조기 병기 개입, 정밀 타깃 전략, 내성 극복을 위한 새 병용 가능성 제시'등을 핵심 방향으로 제시했다. 특히 아스트라제네카는 이번 발표를 통해 아시아가 앞으로의 글로벌 항암 생태계에서 결정적 역할을 할 것이라는 점을 분명히 했다. 임상 환자의 60~70%가 아시아에서 모집되고, 대다수 연구가 아시아 데이터 기반으로 구성되는 만큼, 향후 신약 허가·급여 논의에도 아시아 중심의 근거 반영이 더욱 중요해질 것으로 전망된다 오사마 라마 아스트라제네카 부사장은 "효과적인 치료를 질병의 더 초기 단계로 이동시키는 것을 목표로 하고 있다. 더 이른 시점에 개입할수록 더 많은 환자를 완치에 가깝게 이끌 수 있기 때문"이라며 "소화기암 임상시험에 참여하는 환자의 60~70%가 아시아에서 모집되고 있으며, 이 지역 곳곳에 약 50개의 활성 임상시험 사이트가 운영 중이다. 아시아 전역의 연구자와 임상의 여러분의 긴밀한 협력을 이어나갈 것"이라고 전했다. 실비아 부사장은 "아시아 암환자들의 비율은 지속 늘어나고 있다. 특히 인구 증가, 고령화, 산업화, 환경·직업성 발암물질 노출 증가, 생활습관 변화로 인해 아시아의 암 부담은 더욱 늘어날 것으로 예상된다"라며 "아스트라제네카는 2030년까지 20개의 신약 출시를 목표로 하고 있으며, 이 중 절반이 암 분야 신약이다. 우리의 비전은 치료 혁신을 통해 암을 사망 원인에서 제거하고, 진단·치료·조기 발견 접근성을 높여 의료 형평성을 실현하는 것"이라고 피력했다.2025-12-10 12:03:53손형민 기자 -
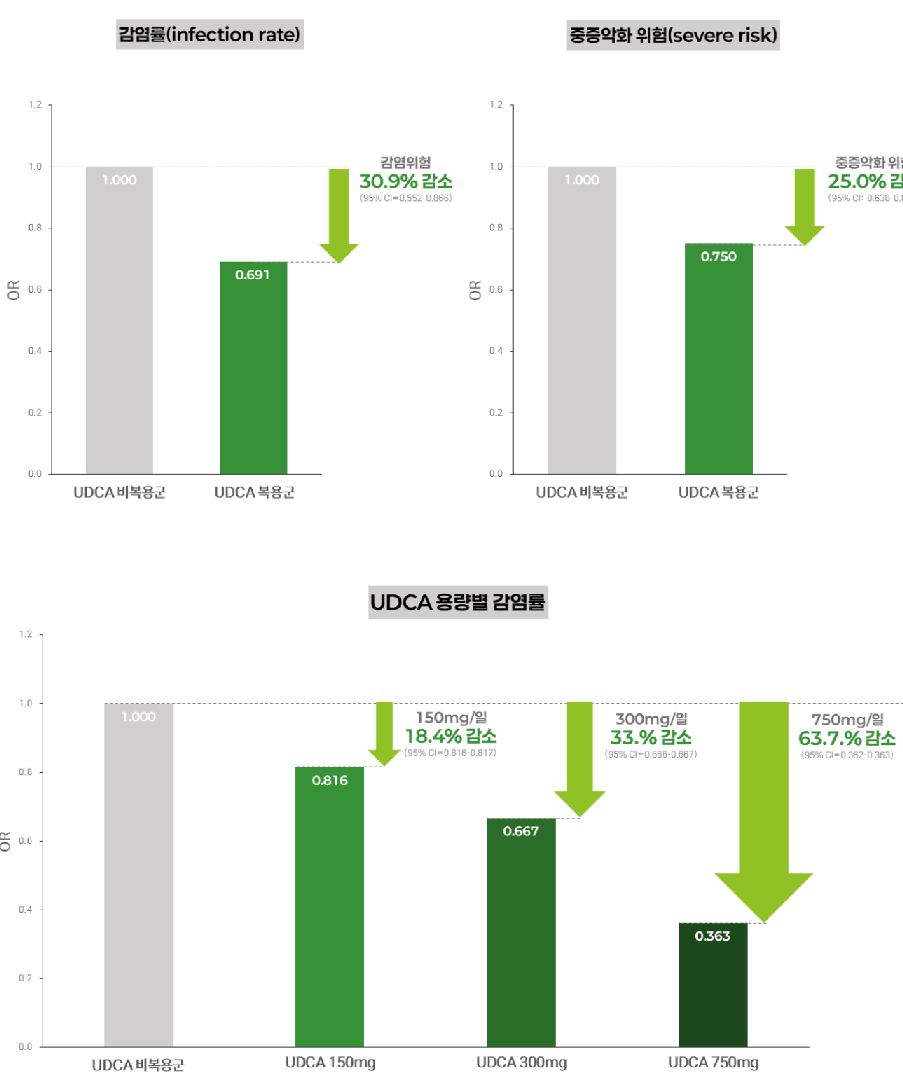 "우루사 주성분 UDCA, 코로나 감염 최대 64% 낮춘다"[데일리팜=이석준 기자] 국민 간장약 우루사의 주성분 UDCA의 코로나19 예방 효과가 ‘글로벌’에서도 입증됐다. 대웅제약(대표 이창재∙박성수)은 UDCA(우르소데옥시콜산)의 코로나19 감염 및 중증 악화 위험을 유의하게 낮추는 효과가 확인된 글로벌 데이터 분석 결과가 ‘KDDW 2025(제9차 소화기연관학회 국제 소화기 학술대회)’에서 발표됐다고 4일 밝혔다. KDDW는 국내 8개 소화기학회가 공동 주최하는 아시아 대표 소화기학 국제학술대회로, 매년 전 세계 35개국 2000명 이상 전문가들이 참여하는 권위 있는 학술 행사다. 글로벌 데이터 통합 분석해 입증한 최초 사례 이번 연구는 한국을 포함한 미국, 중국, 일본, 프랑스, 이탈리아 등 총 6개국의 코호트(71만 명) 데이터를 통합 분석해 UDCA의 코로나19 감염 및 중증 악화 억제 효과를 정량적으로 입증한 최초의 대규모 분석이다. 다국가 데이터를 기반으로 복용량이 증가할수록 감염 위험이 단계적으로 감소하는 경향을 확인하며 UDCA의 예방 효과에 대한 임상적 근거를 한층 강화했다. 이러한 대규모 통합 결과는 기존 연구들의 흐름과도 일치한다. 영국 케임브리지대 연구팀은 2022년 국제학술지 네이처(Nature)에서 UDCA의 코로나19 감염 차단 기전을 규명한 바 있으며, 국내에서는 2024년 전북대학교병원과 동아대학교병원 연구팀이 대규모 코호트 연구를 통해 UDCA의 코로나19 감염과 중증 진행을 예방하는 효과를 입증한 바 있다. 이번 연구 결과는 우수포스터상(Excellent Poster Award)을 수상하며 학술적, 임상적 가치를 모두 인정받았다. 대규모 데이터를 기반으로 한 방법론적 완성도와 ‘용량-반응’ 분석을 통해 향후 임상적 논의에 활용될 수 있는 중요한 실마리를 제공했다는 점에서 높은 평가를 받았다. 이번 연구는 11월 6~7일 열린 대한감염학회 추계학술대회에서도 초록이 채택돼 포스터 발표로 소개됐다. 코로나19 감염 31% 감소, 중증 악화·인공호흡기 사용 25% 감소 확인 건양대학교병원 허규찬 교수(연구책임자) 연구팀이 주도한 이번 연구에서, UDCA 복용군은 비복용군 대비 ▲COVID-19 감염 위험 31% 감소, ▲중증 악화 위험 25% 감소, ▲인공호흡기 사용 위험 25% 감소하는 결과를 보였다. 이는 통계적 측면뿐 아니라 임상적으로도 매우 중대한 감소폭이다. UDCA를 복용한 사람들이 그렇지 않은 사람들에 비해 코로나19에 걸릴 확률 자체가 현저히 낮아지며, 감염되더라도 중환자실 치료가 필요한 심각한 상황으로 진행될 가능성이 4분의 1가량 줄어든다는 의미다. 용량 증가할수록 예방 효과 뚜렷... 최대 63.7% 감염률 낮춰 특히 이번 연구의 가장 큰 차별점은 '용량-반응 메타분석'을 수행했다는 점이다. 복용량이 늘수록 감염률이 단계적으로 낮아지는 용량-반응 관계를 통계적으로 확인했다. 연구에 따르면 ▲150mg 복용 시 감염률 18% 감소, ▲300mg에선 33% 감소, ▲750mg에선 64% 감소하는 것으로 나타났다. 연구진은 코로나19 예방을 목표로 할 경우, 최소 하루 300mg 이상의 용량을 복용할 때 예방 효과가 더욱 뚜렷해진다는 유의미한 기초 근거를 확인했다. 특히 UDCA는 바이러스 자체가 아니라 우리 몸의 수용체(ACE2)를 타깃으로 하는 작용 기전을 가지고 있어서 바이러스 변이에 상대적으로 영향을 덜 받는다. 연구진도 "UDCA는 코로나19 바이러스의 세포 침투 경로인 ACE2 수용체 발현을 감소시켜 바이러스의 침투를 억제할 수 있다"고 설명했다. 또한 “UDCA는 경구 복용이 가능하고, 비용이 저렴하며, 약국에서도 쉽게 구할 수 있어 백신 접근성이 낮은 국가나 면역저하 환자군에게 현실적인 예방 수단이 될 수 있다”고 덧붙였다. 대웅제약 관계자는 “이번 연구는 전 세계 6개국, 71만 명의 데이터를 통합해 UDCA의 코로나19 예방 가능성과 중증화 억제 효과를 대규모 메타분석을 통해 확인한 첫 글로벌 사례다. 효과와 안전성이 오랜 시간 검증된 UDCA가 감염병 대응의 새로운 솔루션으로 잠재력을 보여준 점이 주목할 만하다”고 전했다.2025-12-04 11:48:45이석준 기자
"우루사 주성분 UDCA, 코로나 감염 최대 64% 낮춘다"[데일리팜=이석준 기자] 국민 간장약 우루사의 주성분 UDCA의 코로나19 예방 효과가 ‘글로벌’에서도 입증됐다. 대웅제약(대표 이창재∙박성수)은 UDCA(우르소데옥시콜산)의 코로나19 감염 및 중증 악화 위험을 유의하게 낮추는 효과가 확인된 글로벌 데이터 분석 결과가 ‘KDDW 2025(제9차 소화기연관학회 국제 소화기 학술대회)’에서 발표됐다고 4일 밝혔다. KDDW는 국내 8개 소화기학회가 공동 주최하는 아시아 대표 소화기학 국제학술대회로, 매년 전 세계 35개국 2000명 이상 전문가들이 참여하는 권위 있는 학술 행사다. 글로벌 데이터 통합 분석해 입증한 최초 사례 이번 연구는 한국을 포함한 미국, 중국, 일본, 프랑스, 이탈리아 등 총 6개국의 코호트(71만 명) 데이터를 통합 분석해 UDCA의 코로나19 감염 및 중증 악화 억제 효과를 정량적으로 입증한 최초의 대규모 분석이다. 다국가 데이터를 기반으로 복용량이 증가할수록 감염 위험이 단계적으로 감소하는 경향을 확인하며 UDCA의 예방 효과에 대한 임상적 근거를 한층 강화했다. 이러한 대규모 통합 결과는 기존 연구들의 흐름과도 일치한다. 영국 케임브리지대 연구팀은 2022년 국제학술지 네이처(Nature)에서 UDCA의 코로나19 감염 차단 기전을 규명한 바 있으며, 국내에서는 2024년 전북대학교병원과 동아대학교병원 연구팀이 대규모 코호트 연구를 통해 UDCA의 코로나19 감염과 중증 진행을 예방하는 효과를 입증한 바 있다. 이번 연구 결과는 우수포스터상(Excellent Poster Award)을 수상하며 학술적, 임상적 가치를 모두 인정받았다. 대규모 데이터를 기반으로 한 방법론적 완성도와 ‘용량-반응’ 분석을 통해 향후 임상적 논의에 활용될 수 있는 중요한 실마리를 제공했다는 점에서 높은 평가를 받았다. 이번 연구는 11월 6~7일 열린 대한감염학회 추계학술대회에서도 초록이 채택돼 포스터 발표로 소개됐다. 코로나19 감염 31% 감소, 중증 악화·인공호흡기 사용 25% 감소 확인 건양대학교병원 허규찬 교수(연구책임자) 연구팀이 주도한 이번 연구에서, UDCA 복용군은 비복용군 대비 ▲COVID-19 감염 위험 31% 감소, ▲중증 악화 위험 25% 감소, ▲인공호흡기 사용 위험 25% 감소하는 결과를 보였다. 이는 통계적 측면뿐 아니라 임상적으로도 매우 중대한 감소폭이다. UDCA를 복용한 사람들이 그렇지 않은 사람들에 비해 코로나19에 걸릴 확률 자체가 현저히 낮아지며, 감염되더라도 중환자실 치료가 필요한 심각한 상황으로 진행될 가능성이 4분의 1가량 줄어든다는 의미다. 용량 증가할수록 예방 효과 뚜렷... 최대 63.7% 감염률 낮춰 특히 이번 연구의 가장 큰 차별점은 '용량-반응 메타분석'을 수행했다는 점이다. 복용량이 늘수록 감염률이 단계적으로 낮아지는 용량-반응 관계를 통계적으로 확인했다. 연구에 따르면 ▲150mg 복용 시 감염률 18% 감소, ▲300mg에선 33% 감소, ▲750mg에선 64% 감소하는 것으로 나타났다. 연구진은 코로나19 예방을 목표로 할 경우, 최소 하루 300mg 이상의 용량을 복용할 때 예방 효과가 더욱 뚜렷해진다는 유의미한 기초 근거를 확인했다. 특히 UDCA는 바이러스 자체가 아니라 우리 몸의 수용체(ACE2)를 타깃으로 하는 작용 기전을 가지고 있어서 바이러스 변이에 상대적으로 영향을 덜 받는다. 연구진도 "UDCA는 코로나19 바이러스의 세포 침투 경로인 ACE2 수용체 발현을 감소시켜 바이러스의 침투를 억제할 수 있다"고 설명했다. 또한 “UDCA는 경구 복용이 가능하고, 비용이 저렴하며, 약국에서도 쉽게 구할 수 있어 백신 접근성이 낮은 국가나 면역저하 환자군에게 현실적인 예방 수단이 될 수 있다”고 덧붙였다. 대웅제약 관계자는 “이번 연구는 전 세계 6개국, 71만 명의 데이터를 통합해 UDCA의 코로나19 예방 가능성과 중증화 억제 효과를 대규모 메타분석을 통해 확인한 첫 글로벌 사례다. 효과와 안전성이 오랜 시간 검증된 UDCA가 감염병 대응의 새로운 솔루션으로 잠재력을 보여준 점이 주목할 만하다”고 전했다.2025-12-04 11:48:45이석준 기자 -
 서영준 서울대 약대 명예교수 '제이비케이랩', '셀메드' 소개[데일리팜=최다은 기자] 제약·바이오기업 제이비케이랩(대표 장봉근, 의학·약학박사)은 지난달 26일부터 29일까지 제주 오션스위츠호텔에서 열린 ‘2025 SFRR-KOREA International Symposium(프리라디컬학회 국제심포지엄)’에서 서울대학교 약학대학 서영준 명예교수가 초청 강연을 통해 제이비케이랩과 세포교정영양요법을 국제 연구자들에게 소개했다고 3일 밝혔다. SFRR(프리라디컬학회)은 산화스트레스·항산화 생물학·노화·염증·만성질환의 분자 기전을 탐구하는 세계적 학술기관으로, SFRR-Europe·SFRR-International과 함께 글로벌 연구 네트워크를 구축해왔다. 올해 SFRR-Korea 학술대회에는 국내외 교수·임상 전문가·생명과학 연구진이 대거 참여해 최신 연구 데이터를 공유하며 치열한 학술 논의가 이뤄졌다. 서영준 교수는 서울대 약대에서 오랜 기간 연구와 인재 양성에 기여해온 산화스트레스·항염증·발암 기전 분야 권위자다. NF-κB·COX-2 등 주요 신호전달 기전 규명과 항암·항산화 천연물 기반 연구로 국제적 평가를 받아왔다. 이번 강연에서 그는 ‘질병과 건강에서 자연 비타민과 합성 비타민의 차이’를 주제로 발표하며 ▶항산화제의 잠재적 부작용 ▶자연 유래 비타민의 생체이용률 차이 ▶기존 항산화 전략에 대한 새로운 해석의 필요성을 최신 글로벌 연구 데이터를 바탕으로 제시해 큰 호응을 얻었다. 이 과정에서 서 교수는 천연영양소 기반 의약품과 유전자분석 기술을 접목해 연구를 선도 중인 제이비케이랩의 연구 전략을 소개하며 “제이비케이랩은 세포 건강 회복과 인체 본연의 치유력 증진을 목표로 연구·개발을 지속하며 글로벌 바이오 연구의 새로운 지평을 열고 있다”고 설명했다. 제이비케이랩은 세포 기능 회복을 돕는 영양 기반 접근법 세포교정영양요법(Ortho-Cellular Nutrient Therapy, OCNT)을 기반으로, 국내 약학계에서 활동 중인 약사 중심의 세포교정의약학회(OMPA)와 공동 연구를 전개하고 있다. 세포교정의약학회는 2010년 설립돼 현재 약 2900명의 약사가 참여하고 있다. 국제 학술지 CELLMED를 통해 140여 건의 임상 증례 논문을 발표하는 등 학술 활동을 활발히 이어가고 있다. 서 교수는 이번 심포지엄에서 세포교정의약학회 학술지 ‘CELLMED’도 함께 소개하며 “의학·약학·임상의학·예방의학뿐 아니라 인문학과의 융합 연구까지 다루는 학술지인 만큼 SFRR를 중심으로 축적된 자연물 항산화·레독스 연구 성과가 CELLMED에 적극적으로 투고되기를 바란다”고 제언했다.2025-12-04 09:26:23최다은 기자
서영준 서울대 약대 명예교수 '제이비케이랩', '셀메드' 소개[데일리팜=최다은 기자] 제약·바이오기업 제이비케이랩(대표 장봉근, 의학·약학박사)은 지난달 26일부터 29일까지 제주 오션스위츠호텔에서 열린 ‘2025 SFRR-KOREA International Symposium(프리라디컬학회 국제심포지엄)’에서 서울대학교 약학대학 서영준 명예교수가 초청 강연을 통해 제이비케이랩과 세포교정영양요법을 국제 연구자들에게 소개했다고 3일 밝혔다. SFRR(프리라디컬학회)은 산화스트레스·항산화 생물학·노화·염증·만성질환의 분자 기전을 탐구하는 세계적 학술기관으로, SFRR-Europe·SFRR-International과 함께 글로벌 연구 네트워크를 구축해왔다. 올해 SFRR-Korea 학술대회에는 국내외 교수·임상 전문가·생명과학 연구진이 대거 참여해 최신 연구 데이터를 공유하며 치열한 학술 논의가 이뤄졌다. 서영준 교수는 서울대 약대에서 오랜 기간 연구와 인재 양성에 기여해온 산화스트레스·항염증·발암 기전 분야 권위자다. NF-κB·COX-2 등 주요 신호전달 기전 규명과 항암·항산화 천연물 기반 연구로 국제적 평가를 받아왔다. 이번 강연에서 그는 ‘질병과 건강에서 자연 비타민과 합성 비타민의 차이’를 주제로 발표하며 ▶항산화제의 잠재적 부작용 ▶자연 유래 비타민의 생체이용률 차이 ▶기존 항산화 전략에 대한 새로운 해석의 필요성을 최신 글로벌 연구 데이터를 바탕으로 제시해 큰 호응을 얻었다. 이 과정에서 서 교수는 천연영양소 기반 의약품과 유전자분석 기술을 접목해 연구를 선도 중인 제이비케이랩의 연구 전략을 소개하며 “제이비케이랩은 세포 건강 회복과 인체 본연의 치유력 증진을 목표로 연구·개발을 지속하며 글로벌 바이오 연구의 새로운 지평을 열고 있다”고 설명했다. 제이비케이랩은 세포 기능 회복을 돕는 영양 기반 접근법 세포교정영양요법(Ortho-Cellular Nutrient Therapy, OCNT)을 기반으로, 국내 약학계에서 활동 중인 약사 중심의 세포교정의약학회(OMPA)와 공동 연구를 전개하고 있다. 세포교정의약학회는 2010년 설립돼 현재 약 2900명의 약사가 참여하고 있다. 국제 학술지 CELLMED를 통해 140여 건의 임상 증례 논문을 발표하는 등 학술 활동을 활발히 이어가고 있다. 서 교수는 이번 심포지엄에서 세포교정의약학회 학술지 ‘CELLMED’도 함께 소개하며 “의학·약학·임상의학·예방의학뿐 아니라 인문학과의 융합 연구까지 다루는 학술지인 만큼 SFRR를 중심으로 축적된 자연물 항산화·레독스 연구 성과가 CELLMED에 적극적으로 투고되기를 바란다”고 제언했다.2025-12-04 09:26:23최다은 기자 -
 "변화의 파도 속 미래를 선점하라"…대한민국 약사학술제 개막대한약사회(회장 권영희)는 30일 서울 코엑스에서 ‘변화의 파도 올라, 약사의 10년 미래를 선점하라!’를 슬로건으로 제10회 대한민국 약사학술제를 열었다. 권영희 회장은 개회사에서 “우리는 지금 거대한 변화의 파도 앞에 서 있다”며 “AI와 빅데이터, 디지털헬스케어, 개인 맞춤형 치료로 대표되는 보건의료 환경 변화는 약사직능에 새로운 도전과 동시에 새로운 기회를 주고 있다”고 말했다. 권 회장은 “오늘 학술제에서 나온 주제들이 단순 이론 소개에 그치지 않고 약국과 병원 현장에서 바로 활용될 수 있는 실질적 변화의 계기가 되도록 끝까지 챙기겠다”고 덧붙였다. 이어 “최근 한약사문제 해결,기형적 약국 구조 개선, 비대면진료 제도화 대응, 성분명처방 도입, 약사행위 기반 수가 개발, 전문약사제도 정착 등 대응에 노력하고 있다”면서 “어떤 현안도 집행부 노력만으로 완성될 수 없다. 회원 여러분의 관심과 적극적인 참여를 기대한다”고 당부했다. 서영석 더불어민주당 국회의원은 축사에서 “의료환경의 가파른 변화 속 전문가들에 요구하는 부분들도 많아지고 있다”며 “오늘 이 자리가 새로운 약사 역할을 조망하는 소중한 기회가 되길 바란다”고 말했다. 서 의원은 “약사사회가 안고 있는 대체조제, 성분명처방, 한약사, 창고형약국 문제 등 산적한 현안들이 많지만 연대하고 힘을 합치면 잘 헤쳐나갈 수 있다고 본다”면서 “남은 현안들을 해결해 가는데 힘을 보태겠다”고 했다. 더불어민주당 남인순 국회의원은 영상으로, 장종태 더불어민주당 국회의원이 축전으로 축사를 대신했다. 최광훈 총회의장은 축사에서 “10년 전 학술제를 처음 만들었던 만큼 감회가 새롭다”면서 “오늘 행사를 준비해오신 임원, 직원들 모두 수고 많으셨다. 오늘 행사에 참석한 모든 분들 행복하시기 바란다”고 했다. 이날 학술제에서는 실무 중심 학술 세션으로 ▲전문의약품 ▲일반의약품 ▲건강기능식품 등 다앙하게 구성했다. 전문의약품 세션에서는 당뇨·이상지질혈증·심장질환·노인질환 등 각 분야의 명의들이 직접 강연에 나선다. 강의를 통해 의사들이 왜 특정 약을 처방했는지, 그 의학적 판단 과정과 치료 의도를 공유함으로써 약사들의 임상적 이해를 높인다. 일반의약품 세션은 ‘창고형 약국에는 없는 상담력’을 주제로, 복약지도 및 OTC 상담 역량을 강화하는 실전 강의로 구성됐다. 건강기능식품 세션에서는 ‘소분판매(건강기능식품 맞춤 조제)’ 제도를 중심으로, 약사의 건강기능식품 관리 전문성을 강화하고 이를 새로운 조제권 회복의 기회로 삼을 수 있는 방안을 제시한다. 학술대회 주제발표에 대한 시상도 진행됐다. 이전에는 구연, 포스터, 웹툰·UCC, 복약지도 총 4개 부문이 진행됐었지만 올해는 숏폼, 포스터 부문에 대한 수상만 진행됐다. 한편 이날 개회식에는 대한약사회 최광훈 총회의장, 최미영 총회부의장, 최두주 감사, 서국진 한국마약퇴치운동본부 이사장, 정경주 한국병원약사회장, 나영화 한국약학교육협의회 이사장, 김종환 약사공론 사장, 유상준 약학정보원장, 김위학 서울시약사회장, 연제덕 경기도약사회장, 금병미 대구시약사회장, 윤종배 인천시약사회장, 이효선 강원도약사회장, 최종석 경남약사회장 등이 참석했다. [학술대회 수상자] -숏폼부문- ▲대상: 손현진 '당뇨 환자의 복약지도' ▲최우수상: 윤유현 '안약! 그렇게 쓰면 안돼요' ▲최우수상:이진수 '골초가 3개월만에 담배 끊는 방법', 정흥진 '약사가 직접 알려드립니다' ▲우수상: 김주영 '속쓰림의 근본 원인을 케어하자!(1편-공복 / 2편-식후)' ▲우수상: 김태우 '혈압약 꼭 먹어야 하나요?' ▲우수상:송근우 '약국 기반 잇몸질환 초기관리' -포스터부문 심사결과- ▲대상: 민관필 '원 헬스'패러다임을 위한 산업동물 약료 혁신 모델' ▲최우수상: 김민성(제주분회) '대체조제 의약품 관련 지역약국 현황 보고서' ▲최우수상: 백수정·임정미·조윤희·백진희 서울대병원 약제부 '돌봄통합지원법 시대, 환자경험 향상을 위한 환자상담 교육' ▲최우수상: 이규화 '전세계 도핑약물상담 최강국이 되기 위한 지역약국 활성화 방안' ▲우수상: 송명현, 황은경 '2020년 이후 한국 드라마와 영화 속 약사의 이미지 분석' ▲우수상: 정상원, 방소영 '전국체전 및 장애인 체전 스포츠약국 운영 사례를 통한 스포츠약사의 직능 확장 가능성'2025-11-30 12:14:30김지은 기자
"변화의 파도 속 미래를 선점하라"…대한민국 약사학술제 개막대한약사회(회장 권영희)는 30일 서울 코엑스에서 ‘변화의 파도 올라, 약사의 10년 미래를 선점하라!’를 슬로건으로 제10회 대한민국 약사학술제를 열었다. 권영희 회장은 개회사에서 “우리는 지금 거대한 변화의 파도 앞에 서 있다”며 “AI와 빅데이터, 디지털헬스케어, 개인 맞춤형 치료로 대표되는 보건의료 환경 변화는 약사직능에 새로운 도전과 동시에 새로운 기회를 주고 있다”고 말했다. 권 회장은 “오늘 학술제에서 나온 주제들이 단순 이론 소개에 그치지 않고 약국과 병원 현장에서 바로 활용될 수 있는 실질적 변화의 계기가 되도록 끝까지 챙기겠다”고 덧붙였다. 이어 “최근 한약사문제 해결,기형적 약국 구조 개선, 비대면진료 제도화 대응, 성분명처방 도입, 약사행위 기반 수가 개발, 전문약사제도 정착 등 대응에 노력하고 있다”면서 “어떤 현안도 집행부 노력만으로 완성될 수 없다. 회원 여러분의 관심과 적극적인 참여를 기대한다”고 당부했다. 서영석 더불어민주당 국회의원은 축사에서 “의료환경의 가파른 변화 속 전문가들에 요구하는 부분들도 많아지고 있다”며 “오늘 이 자리가 새로운 약사 역할을 조망하는 소중한 기회가 되길 바란다”고 말했다. 서 의원은 “약사사회가 안고 있는 대체조제, 성분명처방, 한약사, 창고형약국 문제 등 산적한 현안들이 많지만 연대하고 힘을 합치면 잘 헤쳐나갈 수 있다고 본다”면서 “남은 현안들을 해결해 가는데 힘을 보태겠다”고 했다. 더불어민주당 남인순 국회의원은 영상으로, 장종태 더불어민주당 국회의원이 축전으로 축사를 대신했다. 최광훈 총회의장은 축사에서 “10년 전 학술제를 처음 만들었던 만큼 감회가 새롭다”면서 “오늘 행사를 준비해오신 임원, 직원들 모두 수고 많으셨다. 오늘 행사에 참석한 모든 분들 행복하시기 바란다”고 했다. 이날 학술제에서는 실무 중심 학술 세션으로 ▲전문의약품 ▲일반의약품 ▲건강기능식품 등 다앙하게 구성했다. 전문의약품 세션에서는 당뇨·이상지질혈증·심장질환·노인질환 등 각 분야의 명의들이 직접 강연에 나선다. 강의를 통해 의사들이 왜 특정 약을 처방했는지, 그 의학적 판단 과정과 치료 의도를 공유함으로써 약사들의 임상적 이해를 높인다. 일반의약품 세션은 ‘창고형 약국에는 없는 상담력’을 주제로, 복약지도 및 OTC 상담 역량을 강화하는 실전 강의로 구성됐다. 건강기능식품 세션에서는 ‘소분판매(건강기능식품 맞춤 조제)’ 제도를 중심으로, 약사의 건강기능식품 관리 전문성을 강화하고 이를 새로운 조제권 회복의 기회로 삼을 수 있는 방안을 제시한다. 학술대회 주제발표에 대한 시상도 진행됐다. 이전에는 구연, 포스터, 웹툰·UCC, 복약지도 총 4개 부문이 진행됐었지만 올해는 숏폼, 포스터 부문에 대한 수상만 진행됐다. 한편 이날 개회식에는 대한약사회 최광훈 총회의장, 최미영 총회부의장, 최두주 감사, 서국진 한국마약퇴치운동본부 이사장, 정경주 한국병원약사회장, 나영화 한국약학교육협의회 이사장, 김종환 약사공론 사장, 유상준 약학정보원장, 김위학 서울시약사회장, 연제덕 경기도약사회장, 금병미 대구시약사회장, 윤종배 인천시약사회장, 이효선 강원도약사회장, 최종석 경남약사회장 등이 참석했다. [학술대회 수상자] -숏폼부문- ▲대상: 손현진 '당뇨 환자의 복약지도' ▲최우수상: 윤유현 '안약! 그렇게 쓰면 안돼요' ▲최우수상:이진수 '골초가 3개월만에 담배 끊는 방법', 정흥진 '약사가 직접 알려드립니다' ▲우수상: 김주영 '속쓰림의 근본 원인을 케어하자!(1편-공복 / 2편-식후)' ▲우수상: 김태우 '혈압약 꼭 먹어야 하나요?' ▲우수상:송근우 '약국 기반 잇몸질환 초기관리' -포스터부문 심사결과- ▲대상: 민관필 '원 헬스'패러다임을 위한 산업동물 약료 혁신 모델' ▲최우수상: 김민성(제주분회) '대체조제 의약품 관련 지역약국 현황 보고서' ▲최우수상: 백수정·임정미·조윤희·백진희 서울대병원 약제부 '돌봄통합지원법 시대, 환자경험 향상을 위한 환자상담 교육' ▲최우수상: 이규화 '전세계 도핑약물상담 최강국이 되기 위한 지역약국 활성화 방안' ▲우수상: 송명현, 황은경 '2020년 이후 한국 드라마와 영화 속 약사의 이미지 분석' ▲우수상: 정상원, 방소영 '전국체전 및 장애인 체전 스포츠약국 운영 사례를 통한 스포츠약사의 직능 확장 가능성'2025-11-30 12:14:30김지은 기자
오늘의 TOP 10
- 1"롯데마트 내 창고형 약국 막아라"…약사단체 반발
- 2제약업계-복지부, 약가정책 평행선…협의 확률 희박
- 3동성제약, 태광산업 품으로…정상화 수순 첫발
- 4LG CNS, 차바이오텍에 100억 투자
- 5"제2의 콜린알포 안된다" 건약, 급여 재평가 확대 촉구
- 6창고형 약국 개설 하남시, 약사회-약국-제약사 한자리에
- 7제이비케이랩·세포교정의약학회, NAPA서 OCNT 소개
- 8참약사 약국체인, 새내기 약사 대상 '트렌드 파마시' 개최
- 9서초구약, ‘맞춤형 건기식’ 겨냥 서초에듀팜 8주 과정 진행
- 10동아ST, 성장호르몬제 디바이스 '그로트로핀-Ⅱ Pen' 출시
-
상품명최고최저평균
-
게보린(10정)4,0003,0003,782
-
노스카나겔(20g)22,00018,00021,195
-
베나치오에프액(75ml)1,000800996
-
비코그린에스(20정)5,0004,5004,625
-
머시론정(21정)10,0008,5009,873






























![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
