총 1,103건
-
 표적치료제에 CAR-T까지…진화하는 백혈병 치료옵션[데일리팜=손형민 기자] 급성림프모구성백혈병(ALL) 치료에 표적치료제와 CAR-T 등 혁신 기전 신약이 속속 합류하며 치료 패러다임이 빠르게 재편되고 있다. 고강도 화학요법과 조혈모세포이식 중심의 기존 치료 한계를 보완해 장기 생존율 향상과 재발 방지에 대한 기대를 키우고 있다.ALL은 성숙하지 않은 림프구계 세포가 골수·말초혈액에서 비정상 증식하는 희귀 혈액암으로, 국내 암 발생의 0.4% 미만을 차지한다. 성인 환자의 5년 전체 생존율은 40~50% 수준, 고령 환자군은 15% 미만에 불과해 완전관해(CR) 이후에도 재발 위험이 높다.제한적 공여자 조건과 환자 건강 상태로 조혈모세포이식이 적용되는 경우도 제한적이며, 이식 후 5년 생존율 역시 58% 수준에 머문다. 이런 한계점 속에서 공고요법을 보완하는 표적치료제와 면역세포 치료제에 대한 의료진의 관심이 집중되고 있다.이중항체 ‘블린사이토’ 공고요법서 장기 생존 이점 입증암젠 '블린사이토' 암젠의 블린사이토(성분명 블리나투모맙)는 세계 최초 BiTE(이중특이적 T세포 결합체) 기전 치료제로, B세포 ALL를 표적으로 한다. 2015년 국내 허가 이후 적응증을 지속적으로 넓혀왔다. 올해 2월에는 필라델피아 염색체 음성(Ph-) 성인·소아 전구 B세포 ALL 환자를 대상으로 최대 4주기 공고요법 투여가 가능하도록 적응증이 추가됐다.공고요법은 완전관해 달성 후 남아 있는 미세잔존질환(MRD)을 제거해 장기 생존율을 높이기 위해 중요한 단계이나, 기존 화학요법과 조혈모세포이식의 한계로 효과적인 치료 옵션이 제한적이었지만 블린사이토의 등장으로 치료 선택지가 확대됐다.블린사이토의 기전은 CD19(백혈병 세포 항원)와 CD3(T세포 표면 항원)를 동시에 결합해 T세포를 활성화하고, 백혈병 세포와의 면역 시냅스를 형성해 perforin·granzyme을 분출, 표적 세포를 사멸시키는 방식이다. 표적이 사멸되면 다시 인근 다른 백혈병 세포를 찾아 공격을 반복한다.적응증 확대의 근거가 된 성인 대상 임상 E1910과 소아 대상 임상 AALL1731에서 블린사이토와 화학요법을 교차 투여한 환자군은 화학요법 단독군 대비 생존 지표가 모두 향상됐다.특히 E1910 임상연구의 경우 3년 추적 관찰 결과, 블린사이토와 화학요법을 교차 투여한 환자군의 전체 생존율(OS)은 85%로, 화학요법 단독 투여 환자군에 비해 사망 위험을 59% 낮췄다. 또 같은 임상연구에서 3년 무재발 생존율(RFS) 역시 블린사이토와 화학요법을 교차 투여한 환자군은 80%, 화학요법 단독 투여한 환자군은 64%로 나타나 임상에 참여한 10명 중 8명에서 재발 없는 생존 효과를 보였다(HR 0.53; 95% CI, 0.32-0.87).블린사이토는 MRD 음성인 소아 ALL 환자를 대상으로 한 임상에서도 재발 위험 감소 및 생존율 개선 등 통계적으로 유의한 결과를 나타냈다.만 1세~10세 미만 소아 전구 B세포 ALL 환자를 대상으로 한 AALL1731 연구 결과, 추적 기간 중앙값 2.5년에서 추정된 3년 무질병 생존율은 블린사이토와 화학요법 교차투여군에서 96.0%로 화학요법 단독투여군 87.9% 대비 향상된 것으로 나타났다.MRD 음성(0.01%) ALL 환자의 3년 전체생존율 비교. 블린사이토군은 항암화학요법군보다 더 긴 생존율을 보였다. 블린사이토의 공고요법 적응증 확대로 인해 장기 생존율 향상과 재발 방지를 위한 치료 옵션이 부족했던 ALL 치료 환경에 있어 조혈모세포이식 전 완치 가능성도 제기된다. CAR-T, 재발·불응 환자서 새로운 기회 ALL 치료 혁신의 또 다른 축은 CAR-T(키메라항원수용체 T세포) 치료제다. 2017년 최초 CAR-T 치료제 ‘킴리아’가 승인된 이후 B세포 혈액암을 겨냥한 다양한 CAR-T 치료제가 잇달아 시장에 진입하고 있다. 기존 항암제에 불응한 환자에게서도 높은 반응률을 보여, 치료 사각지대를 메우는 대안으로 부상했다.노바티스 CAR-T 신약 '킴리아'CAR-T는 특정 암세포에 반응하는 수용체에 T세포를 발현시킨 후 환자에게 주입하는 유전자 세포치료제다. 이 치료제는 기존 항암제에 불응하는 환자들에게 효과를 보일 수 있는 것으로 알려진다. 현재 주요 CAR-T 신약들은 B 세포 급성 림프구성 백혈병, 악성 림프종, 다발골수종 등 혈액암 치료제로 승인된 상황이다.최근에는 새로운 ALL를 타깃하는 새로운 CAR-T 치료제들 개발도 한창이다. 미국 식품의약국(FDA)은 영국 오토루스 테라퓨틱스가 개발한 CD19 유도 유전자 변형 자가 T세포 치료제 ‘오카질’을 재발성 또는 불응성 B-ALL 치료제로 승인했다.FELIX로 명명된 임상 결과, 오카질 투여군은 효능 평가 가능 환자 65명 중 63%가 CR에 도달했고, 3개월 이내 CR 42%에 달했다. 관해 지속기간 중앙값은 14.1개월로 집계됐다.안전성 측면에서도 오카질은 주목받고 있다. 오카질 투여군은 CRS(사이토카인 방출 증후군) 3등급 이상이 3%에 불과했고, 4·5등급 CRS는 없었다. ICANS(면역효과세포 관련 신경독성) 발생률도 7%로 낮았다. 특히 REMS 프로그램 없이 승인된 최초의 CAR-T라는 점에서 의미가 있다.국내 CAR-T 치료제 개발도 빠르게 진행되고 있다. CAR-T 전문기업 큐로셀은 건강한 공여자 세포를 활용한 동종유래 CAR-T 치료제 개발에 집중, 기존 자가유래 CAR-T 치료제 한계를 극복하고 있다.올해 미국암연구학회(AACR)에서 발표한 비임상 연구에 따르면, 큐로셀의 ‘CD5 감마델타 CAR-T’는 T세포 유래 혈액암(T-ALL, 말초 T세포 림프종 등)에서 강력한 항암 효과를 보였다. 특히 ‘막 결합형 IL-18(mbIL-18)’ 기술로 증식 능력이 기존 치료제 대비 10배 이상 향상됐으며, 동종살해(Fratricide) 현상과 암세포 주변 면역 억제 환경을 동시에 극복했다.전문가들은 표적, 면역항암제와 CAR-T의 결합이 성인·고령 환자군의 생존율 향상에 결정적인 변화를 가져올 것으로 보고 있다.기존 화학요법·이식만으로는 치료 한계가 명확했던 고위험군에서도 재발 방지와 장기 생존이 가능한 치료 전략이 가능해지고 있다는 분석이다. 향후 차세대 CAR-T와 면역항암제의 임상 확대가 ALL 완치율을 높이는 핵심 변수로 작용할 전망이다.2025-08-21 06:18:04손형민
표적치료제에 CAR-T까지…진화하는 백혈병 치료옵션[데일리팜=손형민 기자] 급성림프모구성백혈병(ALL) 치료에 표적치료제와 CAR-T 등 혁신 기전 신약이 속속 합류하며 치료 패러다임이 빠르게 재편되고 있다. 고강도 화학요법과 조혈모세포이식 중심의 기존 치료 한계를 보완해 장기 생존율 향상과 재발 방지에 대한 기대를 키우고 있다.ALL은 성숙하지 않은 림프구계 세포가 골수·말초혈액에서 비정상 증식하는 희귀 혈액암으로, 국내 암 발생의 0.4% 미만을 차지한다. 성인 환자의 5년 전체 생존율은 40~50% 수준, 고령 환자군은 15% 미만에 불과해 완전관해(CR) 이후에도 재발 위험이 높다.제한적 공여자 조건과 환자 건강 상태로 조혈모세포이식이 적용되는 경우도 제한적이며, 이식 후 5년 생존율 역시 58% 수준에 머문다. 이런 한계점 속에서 공고요법을 보완하는 표적치료제와 면역세포 치료제에 대한 의료진의 관심이 집중되고 있다.이중항체 ‘블린사이토’ 공고요법서 장기 생존 이점 입증암젠 '블린사이토' 암젠의 블린사이토(성분명 블리나투모맙)는 세계 최초 BiTE(이중특이적 T세포 결합체) 기전 치료제로, B세포 ALL를 표적으로 한다. 2015년 국내 허가 이후 적응증을 지속적으로 넓혀왔다. 올해 2월에는 필라델피아 염색체 음성(Ph-) 성인·소아 전구 B세포 ALL 환자를 대상으로 최대 4주기 공고요법 투여가 가능하도록 적응증이 추가됐다.공고요법은 완전관해 달성 후 남아 있는 미세잔존질환(MRD)을 제거해 장기 생존율을 높이기 위해 중요한 단계이나, 기존 화학요법과 조혈모세포이식의 한계로 효과적인 치료 옵션이 제한적이었지만 블린사이토의 등장으로 치료 선택지가 확대됐다.블린사이토의 기전은 CD19(백혈병 세포 항원)와 CD3(T세포 표면 항원)를 동시에 결합해 T세포를 활성화하고, 백혈병 세포와의 면역 시냅스를 형성해 perforin·granzyme을 분출, 표적 세포를 사멸시키는 방식이다. 표적이 사멸되면 다시 인근 다른 백혈병 세포를 찾아 공격을 반복한다.적응증 확대의 근거가 된 성인 대상 임상 E1910과 소아 대상 임상 AALL1731에서 블린사이토와 화학요법을 교차 투여한 환자군은 화학요법 단독군 대비 생존 지표가 모두 향상됐다.특히 E1910 임상연구의 경우 3년 추적 관찰 결과, 블린사이토와 화학요법을 교차 투여한 환자군의 전체 생존율(OS)은 85%로, 화학요법 단독 투여 환자군에 비해 사망 위험을 59% 낮췄다. 또 같은 임상연구에서 3년 무재발 생존율(RFS) 역시 블린사이토와 화학요법을 교차 투여한 환자군은 80%, 화학요법 단독 투여한 환자군은 64%로 나타나 임상에 참여한 10명 중 8명에서 재발 없는 생존 효과를 보였다(HR 0.53; 95% CI, 0.32-0.87).블린사이토는 MRD 음성인 소아 ALL 환자를 대상으로 한 임상에서도 재발 위험 감소 및 생존율 개선 등 통계적으로 유의한 결과를 나타냈다.만 1세~10세 미만 소아 전구 B세포 ALL 환자를 대상으로 한 AALL1731 연구 결과, 추적 기간 중앙값 2.5년에서 추정된 3년 무질병 생존율은 블린사이토와 화학요법 교차투여군에서 96.0%로 화학요법 단독투여군 87.9% 대비 향상된 것으로 나타났다.MRD 음성(0.01%) ALL 환자의 3년 전체생존율 비교. 블린사이토군은 항암화학요법군보다 더 긴 생존율을 보였다. 블린사이토의 공고요법 적응증 확대로 인해 장기 생존율 향상과 재발 방지를 위한 치료 옵션이 부족했던 ALL 치료 환경에 있어 조혈모세포이식 전 완치 가능성도 제기된다. CAR-T, 재발·불응 환자서 새로운 기회 ALL 치료 혁신의 또 다른 축은 CAR-T(키메라항원수용체 T세포) 치료제다. 2017년 최초 CAR-T 치료제 ‘킴리아’가 승인된 이후 B세포 혈액암을 겨냥한 다양한 CAR-T 치료제가 잇달아 시장에 진입하고 있다. 기존 항암제에 불응한 환자에게서도 높은 반응률을 보여, 치료 사각지대를 메우는 대안으로 부상했다.노바티스 CAR-T 신약 '킴리아'CAR-T는 특정 암세포에 반응하는 수용체에 T세포를 발현시킨 후 환자에게 주입하는 유전자 세포치료제다. 이 치료제는 기존 항암제에 불응하는 환자들에게 효과를 보일 수 있는 것으로 알려진다. 현재 주요 CAR-T 신약들은 B 세포 급성 림프구성 백혈병, 악성 림프종, 다발골수종 등 혈액암 치료제로 승인된 상황이다.최근에는 새로운 ALL를 타깃하는 새로운 CAR-T 치료제들 개발도 한창이다. 미국 식품의약국(FDA)은 영국 오토루스 테라퓨틱스가 개발한 CD19 유도 유전자 변형 자가 T세포 치료제 ‘오카질’을 재발성 또는 불응성 B-ALL 치료제로 승인했다.FELIX로 명명된 임상 결과, 오카질 투여군은 효능 평가 가능 환자 65명 중 63%가 CR에 도달했고, 3개월 이내 CR 42%에 달했다. 관해 지속기간 중앙값은 14.1개월로 집계됐다.안전성 측면에서도 오카질은 주목받고 있다. 오카질 투여군은 CRS(사이토카인 방출 증후군) 3등급 이상이 3%에 불과했고, 4·5등급 CRS는 없었다. ICANS(면역효과세포 관련 신경독성) 발생률도 7%로 낮았다. 특히 REMS 프로그램 없이 승인된 최초의 CAR-T라는 점에서 의미가 있다.국내 CAR-T 치료제 개발도 빠르게 진행되고 있다. CAR-T 전문기업 큐로셀은 건강한 공여자 세포를 활용한 동종유래 CAR-T 치료제 개발에 집중, 기존 자가유래 CAR-T 치료제 한계를 극복하고 있다.올해 미국암연구학회(AACR)에서 발표한 비임상 연구에 따르면, 큐로셀의 ‘CD5 감마델타 CAR-T’는 T세포 유래 혈액암(T-ALL, 말초 T세포 림프종 등)에서 강력한 항암 효과를 보였다. 특히 ‘막 결합형 IL-18(mbIL-18)’ 기술로 증식 능력이 기존 치료제 대비 10배 이상 향상됐으며, 동종살해(Fratricide) 현상과 암세포 주변 면역 억제 환경을 동시에 극복했다.전문가들은 표적, 면역항암제와 CAR-T의 결합이 성인·고령 환자군의 생존율 향상에 결정적인 변화를 가져올 것으로 보고 있다.기존 화학요법·이식만으로는 치료 한계가 명확했던 고위험군에서도 재발 방지와 장기 생존이 가능한 치료 전략이 가능해지고 있다는 분석이다. 향후 차세대 CAR-T와 면역항암제의 임상 확대가 ALL 완치율을 높이는 핵심 변수로 작용할 전망이다.2025-08-21 06:18:04손형민 -
 동아ST, 크리스탈파이와 면역·염증 질환 치료제 공동연구[데일리팜=손형민 기자] 동아에스티(대표이사 사장 정재훈)는 인공지능(AI) 신약개발 기업 크리스탈파이(XtalPi, 대표이사 Jian Ma)와 면역 및 염증 치료제 개발을 위한 공동연구 업무협약을 체결했다고 20일 밝혔다.이번 협약은 크리스탈파이의 AI, 양자물리학, 자동화 로보틱스 기술이 융합된 지능형 자동 신약개발 플랫폼을 기반으로 진행된다. 양사는 플랫폼을 활용해 면역 및 염증 질환의 신규 타깃을 발굴하고, 퍼스트 인 클래스(first-in-class) 및 베스트 인 클래스(best-in-class) 후보 물질을 탐색할 계획이다.크리스탈파이의 플랫폼은 AI의 속도와 생성 능력, 로봇 기반 자동화 실험의 정확성을 결합해 신약개발 속도를 높이고 탐색 가능한 화학적 공간을 획기적으로 확장할 수 있다. 크리스탈파이의 플랫폼을 통해 ▲딥러닝 기반 분자 설계 ▲약물-표적 상호작용 예측을 위한 양자물리학·분자동역학 시뮬레이션 ▲자동화된 화학 합성 ▲후보 물질의 핵심 약리학적 특성 실험 검증 등을 진행할 예정이다.동아에스티는 ▲후보물질 타당성 평가 ▲약효 및 안전성 검증 ▲전임상 및 임상 개발 전략 수립 등 전체 연구개발 과정에 참여한다. 향후 파이프라인 확대와 상업화 가능성에 대한 검토도 함께 수행할 계획이다.크리스탈파이는 2015년 메사추세츠 공과대학교(MIT)의 양자물리학 전문가들이 설립한 기업으로 생명과학 및 신소재 분야에서 다수의 글로벌 기업들과 파트너십을 체결했으며 글로벌 제약사들과도 활발히 협력 중이다.크리스탈파이 신약개발 수석부사장 존 왕(John Wang)은 “동아에스티의 풍부한 전문성과 크리스탈파이의 검증된 AI-로보틱스 플랫폼의 결합은 과학적 혁신을 경쟁력 있는 정밀의약으로 전환할 수 있는 강력한 조합이다”며, “양사는 다중 모달리티에 걸쳐 신속하게 신약 후보를 발굴 및 검증하고, 글로벌 환자들에게 혁신적 치료제를 제공해 새로운 시장 기회를 창출할 것이다”고 말했다.박재홍 동아에스티 R&D 총괄 사장은 “동아에스티는 저분자 화합물 중심의 신약 개발에서 표적단백질 분해제(TPD), 바이오의약품, 항체-약물접합체(ADC), 유전자 치료제 등으로 연구개발 영역을 전환하고 있으며, 이번 협력이 전환을 가속화하는 중요한 계기가 될 것이다”며 “크리스탈파이 AI 플랫폼과의 시너지를 통해 차세대 면역·염증 질환 치료제 개발에 속도를 내겠다”고 말했다.동아에스티와 크리스탈파이는 미국 보스턴에 오픈이노베이션 센터를 운영하고 있으며, 지리적 이점을 활용해 긴밀하고 효율적인 신약개발 공동연구를 추진할 계획이다. 동아에스티는 오픈이노베이션 센터를 통해 글로벌 시장에서 잠재적 미래가치가 있는 기술 및 플랫폼 발굴, 시장 조사 및 네트워킹 활동을 전개하고 있다.2025-08-20 09:56:41손형민
동아ST, 크리스탈파이와 면역·염증 질환 치료제 공동연구[데일리팜=손형민 기자] 동아에스티(대표이사 사장 정재훈)는 인공지능(AI) 신약개발 기업 크리스탈파이(XtalPi, 대표이사 Jian Ma)와 면역 및 염증 치료제 개발을 위한 공동연구 업무협약을 체결했다고 20일 밝혔다.이번 협약은 크리스탈파이의 AI, 양자물리학, 자동화 로보틱스 기술이 융합된 지능형 자동 신약개발 플랫폼을 기반으로 진행된다. 양사는 플랫폼을 활용해 면역 및 염증 질환의 신규 타깃을 발굴하고, 퍼스트 인 클래스(first-in-class) 및 베스트 인 클래스(best-in-class) 후보 물질을 탐색할 계획이다.크리스탈파이의 플랫폼은 AI의 속도와 생성 능력, 로봇 기반 자동화 실험의 정확성을 결합해 신약개발 속도를 높이고 탐색 가능한 화학적 공간을 획기적으로 확장할 수 있다. 크리스탈파이의 플랫폼을 통해 ▲딥러닝 기반 분자 설계 ▲약물-표적 상호작용 예측을 위한 양자물리학·분자동역학 시뮬레이션 ▲자동화된 화학 합성 ▲후보 물질의 핵심 약리학적 특성 실험 검증 등을 진행할 예정이다.동아에스티는 ▲후보물질 타당성 평가 ▲약효 및 안전성 검증 ▲전임상 및 임상 개발 전략 수립 등 전체 연구개발 과정에 참여한다. 향후 파이프라인 확대와 상업화 가능성에 대한 검토도 함께 수행할 계획이다.크리스탈파이는 2015년 메사추세츠 공과대학교(MIT)의 양자물리학 전문가들이 설립한 기업으로 생명과학 및 신소재 분야에서 다수의 글로벌 기업들과 파트너십을 체결했으며 글로벌 제약사들과도 활발히 협력 중이다.크리스탈파이 신약개발 수석부사장 존 왕(John Wang)은 “동아에스티의 풍부한 전문성과 크리스탈파이의 검증된 AI-로보틱스 플랫폼의 결합은 과학적 혁신을 경쟁력 있는 정밀의약으로 전환할 수 있는 강력한 조합이다”며, “양사는 다중 모달리티에 걸쳐 신속하게 신약 후보를 발굴 및 검증하고, 글로벌 환자들에게 혁신적 치료제를 제공해 새로운 시장 기회를 창출할 것이다”고 말했다.박재홍 동아에스티 R&D 총괄 사장은 “동아에스티는 저분자 화합물 중심의 신약 개발에서 표적단백질 분해제(TPD), 바이오의약품, 항체-약물접합체(ADC), 유전자 치료제 등으로 연구개발 영역을 전환하고 있으며, 이번 협력이 전환을 가속화하는 중요한 계기가 될 것이다”며 “크리스탈파이 AI 플랫폼과의 시너지를 통해 차세대 면역·염증 질환 치료제 개발에 속도를 내겠다”고 말했다.동아에스티와 크리스탈파이는 미국 보스턴에 오픈이노베이션 센터를 운영하고 있으며, 지리적 이점을 활용해 긴밀하고 효율적인 신약개발 공동연구를 추진할 계획이다. 동아에스티는 오픈이노베이션 센터를 통해 글로벌 시장에서 잠재적 미래가치가 있는 기술 및 플랫폼 발굴, 시장 조사 및 네트워킹 활동을 전개하고 있다.2025-08-20 09:56:41손형민 -
 'GLP-1 신약도 가세'...MASH 정복 글로벌 경쟁 각축[데일리팜=손형민 기자] 대사이상 관련 지방간염(MASH) 치료제 시장이 본격적인 경쟁 국면에 접어들고 있다. 노보노디스크의 GLP-1 계열 신약 ‘세마글루타이드(위고비·오젬픽 성분)’가 MASH 치료제로 허가되면서다. 지난해 3월 승인된 마드리갈의 ‘레즈디프라’에 이어 두번째로 FDA 문턱을 넘은 약물이 등장하게 됐다.이번 허가로 후발주자들의 개발 움직임에도 탄력을 받을 전망이다. 현재 일라이릴리, 베링거인겔하임, MSD 등 글로벌제약사뿐만 아니라 한미약품, 디앤디파마텍 등 다양한 국내사들이 GLP-1 신약후보물질로 MASH 임상을 진행하고 있다.’팔색조’ GLP-1, 당뇨병·비만 이어 간질환서도 허가GLP-1 계열 당뇨병, 비만 치료제 '오젬픽'과 '위고비'20일 관련 업계에 따르면 미국 식품의약국(FDA)은 최근 세마글루타이드 2.4mg을 성인 비간경변성 MASH 치료제로 허가했다. 이번 허가는 가속 승인으로 추후 진행될 확증 임상 연구를 통해 정식 허가 여부가 결정된다.세마글루타이드는 주 1회 피하주사로 투여하는 GLP-1 수용체 작용제로, 체중감량과 혈당조절 효과를 이미 당뇨병·비만 치료에서 입증한 바 있다.이번 승인으로 GLP-1 제제는 비만과 당뇨, 심혈관질환에 이어 간질환까지 적응증을 넓히게 됐다. 체중감량과 혈당조절이라는 기전적 장점이 간 지방 축적과 염증 억제에 연결되면서 MASH 환자 치료에 효과를 입증한 것이다.허가 기반은 중등도에서 중증 섬유증을 동반한 MASH 환자를 대상으로 진행된 임상3상 ESSENCE 연구다.임상 72주차 중간 분석에서 세마글루타이드는 위약 대비 지방간염 해소와 섬유증 개선에서 유의한 차이를 보였다.간 조직 병리검사 기준 세마글루타이드군의 63%는 섬유증 악화 없이 지방간염이 소실됐다. 위약군은 34%에 그쳤다. 또 세마글루타이드군의 37%는 지방간염 악화 없이 섬유증이 개선되며 위약군 23%보다 높았다. 두 가지 목표를 동시에 달성한 환자 비율은 33%로, 위약군 16%보다 두 배 이상 높았다.노보노디스크는 세미글루타이드의 정식 허가를 위한 ESSENCE 연구 파트2를 진행 중이다. 총 240주 동안 이어지는 이번 연구는 72주 차에서 관찰된 염증과 섬유화 개선 효과가 실제 사망률, 간이식, 기타 간 관련 사건 감소로 이어지는지를 확인하는 것이 목표다.FDA에 따르면 이번 임상은 ‘간경변증 발생 없는 생존’에 미치는 효과를 평가하고 있으며, 궁극적으로는 해당 적응증의 완전 승인 여부가 임상적 유익성을 입증하는지에 달려 있다고 설명했다. GLP-1 MASH 신약 가능성 청신호…국내외 제약 개발 박차이번 허가로 GLP-1 신약후보물질들을 MASH 치료제로 개발 중인 회사들의 임상에도 청신호가 켜졌다. 그간 MASH는 복합적인 발병 기전으로 개발 난이도가 높아 많은 제약사들이 임상에서 좌절을 맛봤다. GLP-1 계열 첫 치료제가 승인된 만큼 임상에 진입한 다양한 제약사들의 신약후보물질도 상용화에 성공할 수 있을지 주목된다.일라이릴리는 터제파타이드의 MASH 임상2상에서 유효성을 확인했다. 터제파타이드는 GLP-1·GIP 이중 작용제로 릴리의 2형 당뇨병 치료제 마운자로, 비만 치료제 젭바운드의 성분과 같다.터제파타이드의 유효성을 평가하기 위한 SYNERGY-NASH 임상2상 연구는 생검으로 확인된 중등도에서 중증 섬유증을 가진 MASH 환자 190명을 대상으로 진행됐다. 임상에서 1차 평가변수로 설정한 52주차에 섬유화 악화 없이 증상을 개선한 비율에서 터제파타이드 5mg은 43.6%, 10mg 55.5%, 15mg 62.4%를 기록했다.베링거인겔하임은 GLP-1·글루카곤 이중 작용제인 서보두타이드의 임상3상 연구를 진행 중이다.서보두타이드는 MASH 환자를 대상으로 한 임상2상에서 48주 이후 증상 악화 비율이 위약군 대비 효과를 보였다.임상 결과, 서보두타이드 투여군은 섬유화 단계의 악화 없이 MASH로 인한 간 질환이 유의하게 개선된 환자 비율이 83%를 기록했다. 이는 위약군 18.2%보다 높은 수치였다. 또 서보두타이드는 간 지방 함량이 30% 이상 감소한 환자 비율이 위약군 대비 높았다.MSD도 글루카곤·GLP-1 이중 작용제 에피노페그듀타이드의 임상2상을 진행하고 있다. 에피노페그듀타이드는 한미약품이 개발한 MASH 신약후보물질로 지난 2020년 MSD에 기술이전됐다. 현재까지 공개된 임상 결과에서 에피노페그듀타이드는 1차 평가변수로 설정한 24주차 간지방 함량을 기저치 대비 72.7% 감소시켰다. 이는 대조군인 세마글루타이드가 기록한 42.3%와 차이가 나는 수치였다디앤디파마텍은 미국 임상2상에 돌입했다. 최근 이 회사는 세마글루타이드군의 62.9%는 DD01의 글로벌 임상2상시험계획(IND)를 승인받았다. DD01은 GLP-1·GCG 이중 수용체 작용제다. DD01은 전임상에서 경쟁력 있는 지방간, 체중 감소 효과를 나타냈다.FGF21 등 다양한 기전 신약개발 모색마드리갈 '레즈디프라'업계는 GLP-1 외에도 다양한 기전으로 돌파구를 모색 중이다.MASH 신약 개발 경쟁은 GLP-1에 국한되지 않는다. 가장 먼저 FDA 승인을 획득한 레즈디프라는 갑상선호르몬 수용체(THR)-β 작용제로, 간 내부 대사 조절을 통해 지방 축적을 억제한다.FGF21 기전 역시 차세대 후보로 부각된다. FGF21은 에너지 소비와 체내 포도당, 지질 대사 조절에 관여해 MASH를 비롯해 비만, 당뇨병 등 치료제 개발에 활용되고 있다.미국 아케로테라퓨틱스의 FGF21 타깃 ‘에프룩시페르민’은 섬유화 2기~3기 환자를 대상으로 한 HARMONY 임상2b에서 섬유화 개선률이 최대 75%에 달했다. 위약군 24% 대비 월등히 높은 결과였으며, 이는 이미 승인받은 레즈디프라보다도 개선 비율이 높다는 점에서 주목을 받았다.일라이릴리는 GLP-1 외에도 국내기업 올릭스의 신약후보물질을 도입하며 MASH 신약 개발에 집중하고 있다.릴리는 지난 2월 MASH, 비만 치료제 후보물질 'OLX75016(OLX702A)'에 대한 공동개발·기술이전 계약을 맺었다. 총 계약 규모는 6억3000만달러(약 9100억원)다. 이는 반환 의무가 없는 선급금과 임상 진척에 따른 개발과 상업화 마일스톤을 합한 액수다. 선급금 비중 등 세부 내역은 공개하지 않았다.OLX75016은 RNA 간섭 기술 가운데 짧은 이중 가닥 RNA 유전물질인 siRNA 기술에 기반한 MASH와 비만 치료제 후보물질이다. OLX75016는 3개월에 1회 투여하는 피하주사(SC) 제형 비만 치료제로 개발되고 있다.올릭스는 현재 OLX75016의 호주 임상 1상을 진행 중이다. 올릭스는 OLX75016과 GLP-1과 글루카곤 등을 타깃하는 신약들과의 병용 가능성도 확인 중이다. 대다수 MASH 치료제들이 GLP-1을 타깃하는 만큼 차별화된 기전을 가진 치료제를 개발해 GLP-1 제제들과의 시너지 효과를 높이겠다는 게 올릭스의 계획이다.2025-08-20 06:16:10손형민
'GLP-1 신약도 가세'...MASH 정복 글로벌 경쟁 각축[데일리팜=손형민 기자] 대사이상 관련 지방간염(MASH) 치료제 시장이 본격적인 경쟁 국면에 접어들고 있다. 노보노디스크의 GLP-1 계열 신약 ‘세마글루타이드(위고비·오젬픽 성분)’가 MASH 치료제로 허가되면서다. 지난해 3월 승인된 마드리갈의 ‘레즈디프라’에 이어 두번째로 FDA 문턱을 넘은 약물이 등장하게 됐다.이번 허가로 후발주자들의 개발 움직임에도 탄력을 받을 전망이다. 현재 일라이릴리, 베링거인겔하임, MSD 등 글로벌제약사뿐만 아니라 한미약품, 디앤디파마텍 등 다양한 국내사들이 GLP-1 신약후보물질로 MASH 임상을 진행하고 있다.’팔색조’ GLP-1, 당뇨병·비만 이어 간질환서도 허가GLP-1 계열 당뇨병, 비만 치료제 '오젬픽'과 '위고비'20일 관련 업계에 따르면 미국 식품의약국(FDA)은 최근 세마글루타이드 2.4mg을 성인 비간경변성 MASH 치료제로 허가했다. 이번 허가는 가속 승인으로 추후 진행될 확증 임상 연구를 통해 정식 허가 여부가 결정된다.세마글루타이드는 주 1회 피하주사로 투여하는 GLP-1 수용체 작용제로, 체중감량과 혈당조절 효과를 이미 당뇨병·비만 치료에서 입증한 바 있다.이번 승인으로 GLP-1 제제는 비만과 당뇨, 심혈관질환에 이어 간질환까지 적응증을 넓히게 됐다. 체중감량과 혈당조절이라는 기전적 장점이 간 지방 축적과 염증 억제에 연결되면서 MASH 환자 치료에 효과를 입증한 것이다.허가 기반은 중등도에서 중증 섬유증을 동반한 MASH 환자를 대상으로 진행된 임상3상 ESSENCE 연구다.임상 72주차 중간 분석에서 세마글루타이드는 위약 대비 지방간염 해소와 섬유증 개선에서 유의한 차이를 보였다.간 조직 병리검사 기준 세마글루타이드군의 63%는 섬유증 악화 없이 지방간염이 소실됐다. 위약군은 34%에 그쳤다. 또 세마글루타이드군의 37%는 지방간염 악화 없이 섬유증이 개선되며 위약군 23%보다 높았다. 두 가지 목표를 동시에 달성한 환자 비율은 33%로, 위약군 16%보다 두 배 이상 높았다.노보노디스크는 세미글루타이드의 정식 허가를 위한 ESSENCE 연구 파트2를 진행 중이다. 총 240주 동안 이어지는 이번 연구는 72주 차에서 관찰된 염증과 섬유화 개선 효과가 실제 사망률, 간이식, 기타 간 관련 사건 감소로 이어지는지를 확인하는 것이 목표다.FDA에 따르면 이번 임상은 ‘간경변증 발생 없는 생존’에 미치는 효과를 평가하고 있으며, 궁극적으로는 해당 적응증의 완전 승인 여부가 임상적 유익성을 입증하는지에 달려 있다고 설명했다. GLP-1 MASH 신약 가능성 청신호…국내외 제약 개발 박차이번 허가로 GLP-1 신약후보물질들을 MASH 치료제로 개발 중인 회사들의 임상에도 청신호가 켜졌다. 그간 MASH는 복합적인 발병 기전으로 개발 난이도가 높아 많은 제약사들이 임상에서 좌절을 맛봤다. GLP-1 계열 첫 치료제가 승인된 만큼 임상에 진입한 다양한 제약사들의 신약후보물질도 상용화에 성공할 수 있을지 주목된다.일라이릴리는 터제파타이드의 MASH 임상2상에서 유효성을 확인했다. 터제파타이드는 GLP-1·GIP 이중 작용제로 릴리의 2형 당뇨병 치료제 마운자로, 비만 치료제 젭바운드의 성분과 같다.터제파타이드의 유효성을 평가하기 위한 SYNERGY-NASH 임상2상 연구는 생검으로 확인된 중등도에서 중증 섬유증을 가진 MASH 환자 190명을 대상으로 진행됐다. 임상에서 1차 평가변수로 설정한 52주차에 섬유화 악화 없이 증상을 개선한 비율에서 터제파타이드 5mg은 43.6%, 10mg 55.5%, 15mg 62.4%를 기록했다.베링거인겔하임은 GLP-1·글루카곤 이중 작용제인 서보두타이드의 임상3상 연구를 진행 중이다.서보두타이드는 MASH 환자를 대상으로 한 임상2상에서 48주 이후 증상 악화 비율이 위약군 대비 효과를 보였다.임상 결과, 서보두타이드 투여군은 섬유화 단계의 악화 없이 MASH로 인한 간 질환이 유의하게 개선된 환자 비율이 83%를 기록했다. 이는 위약군 18.2%보다 높은 수치였다. 또 서보두타이드는 간 지방 함량이 30% 이상 감소한 환자 비율이 위약군 대비 높았다.MSD도 글루카곤·GLP-1 이중 작용제 에피노페그듀타이드의 임상2상을 진행하고 있다. 에피노페그듀타이드는 한미약품이 개발한 MASH 신약후보물질로 지난 2020년 MSD에 기술이전됐다. 현재까지 공개된 임상 결과에서 에피노페그듀타이드는 1차 평가변수로 설정한 24주차 간지방 함량을 기저치 대비 72.7% 감소시켰다. 이는 대조군인 세마글루타이드가 기록한 42.3%와 차이가 나는 수치였다디앤디파마텍은 미국 임상2상에 돌입했다. 최근 이 회사는 세마글루타이드군의 62.9%는 DD01의 글로벌 임상2상시험계획(IND)를 승인받았다. DD01은 GLP-1·GCG 이중 수용체 작용제다. DD01은 전임상에서 경쟁력 있는 지방간, 체중 감소 효과를 나타냈다.FGF21 등 다양한 기전 신약개발 모색마드리갈 '레즈디프라'업계는 GLP-1 외에도 다양한 기전으로 돌파구를 모색 중이다.MASH 신약 개발 경쟁은 GLP-1에 국한되지 않는다. 가장 먼저 FDA 승인을 획득한 레즈디프라는 갑상선호르몬 수용체(THR)-β 작용제로, 간 내부 대사 조절을 통해 지방 축적을 억제한다.FGF21 기전 역시 차세대 후보로 부각된다. FGF21은 에너지 소비와 체내 포도당, 지질 대사 조절에 관여해 MASH를 비롯해 비만, 당뇨병 등 치료제 개발에 활용되고 있다.미국 아케로테라퓨틱스의 FGF21 타깃 ‘에프룩시페르민’은 섬유화 2기~3기 환자를 대상으로 한 HARMONY 임상2b에서 섬유화 개선률이 최대 75%에 달했다. 위약군 24% 대비 월등히 높은 결과였으며, 이는 이미 승인받은 레즈디프라보다도 개선 비율이 높다는 점에서 주목을 받았다.일라이릴리는 GLP-1 외에도 국내기업 올릭스의 신약후보물질을 도입하며 MASH 신약 개발에 집중하고 있다.릴리는 지난 2월 MASH, 비만 치료제 후보물질 'OLX75016(OLX702A)'에 대한 공동개발·기술이전 계약을 맺었다. 총 계약 규모는 6억3000만달러(약 9100억원)다. 이는 반환 의무가 없는 선급금과 임상 진척에 따른 개발과 상업화 마일스톤을 합한 액수다. 선급금 비중 등 세부 내역은 공개하지 않았다.OLX75016은 RNA 간섭 기술 가운데 짧은 이중 가닥 RNA 유전물질인 siRNA 기술에 기반한 MASH와 비만 치료제 후보물질이다. OLX75016는 3개월에 1회 투여하는 피하주사(SC) 제형 비만 치료제로 개발되고 있다.올릭스는 현재 OLX75016의 호주 임상 1상을 진행 중이다. 올릭스는 OLX75016과 GLP-1과 글루카곤 등을 타깃하는 신약들과의 병용 가능성도 확인 중이다. 대다수 MASH 치료제들이 GLP-1을 타깃하는 만큼 차별화된 기전을 가진 치료제를 개발해 GLP-1 제제들과의 시너지 효과를 높이겠다는 게 올릭스의 계획이다.2025-08-20 06:16:10손형민 -
 '렉라자' 미국 진출 1년...글로벌 시장 침투 속도유한양행 렉라자·얀센 리브리반트 [데일리팜=손형민 기자] 유한양행의 국산 폐암신약 ‘렉라자(성분명 레이저티닙, 미국 제품명 라즈클루즈)’가 미국 시장 진출 1년 만에 글로벌 시장에서 영향력을 점차적으로 확대하고 있다. 렉라자와 존슨앤드존슨의 ‘리브리반트’와 병용요법은 글로벌 매출이 빠른 속도로 증가했고 해외 진출 국가도 크게 늘었다.19일 관련 업계에 따르면 렉라자+리브리반트 병용요법은 미국 식품의약국(FDA)으로부터 허가를 획득한 이후 1년이 지났다. 해당 병용요법은 지난해 8월 FDA 허가를 받은 이후 비소세포폐암 치료제 시장에서 영향력을 크게 확대됐다. 렉라자+리브리반트는 올해 상반기에만 매출 3억2000만 달러(약 4500억원)를 기록하며 전년 같은 시점 대비 176% 늘었다.렉라자는 2021년 1월 국산 31호 신약으로 허가받은 비소세포폐암 치료제다. 국내 바이오 기업 오스코텍의 자회사 제노스코가 개발한 렉라자는 지난 2015년 유한양행에 기술이전됐다. 이후 유한양행은 2018년 11월 존슨앤드존슨 자회사 얀센과 1조4000억원 규모의 라이선스 아웃 계약을 체결했다.이후 얀센은 MARIPOSA 임상3상 연구를 통해 기존 표준치료요법(SOC)으로 활용되는 타그리소 단독요법 대비 유효성을 확인했다. 지난해 8월 19일 미국 식품의약국(FDA)은 해당 병용요법을 EGFR 양성 비소세포암 1차 치료제로 허가한 바 있다.특히 ‘표적치료제+표적치료제’ 병용이 글로벌 주요 시장에서 1차 치료제로 승인된 건 이번이 처음이라는 점에서 의의가 크다. 기존에는 백금 기반 항암화학요법과 표적치료제의 병용만 허가된 사례가 있었다. 전문가들은 렉라자+리브리반트 병용요법이 향후 EGFR 양성 비소세포폐암의 새로운 표준치료옵션으로 자리잡을 가능성이 높다고 평가한다.MARIPOSA의 최종 임상 결과, 렉라자+리브리반트군은 타그리소군 대비 통계적으로 유의한 생존율 개선을 보였다(p값 0.005 미만). 뇌전이와 관련된 지표인 두개내(intracranial) 무진행생존기간(PFS)은 렉라자+리브리반트군이 25.4개월, 타그리소군이 22.2개월로 나타났다.또 렉라자 병용요법은 전체생존기간(OS)에서 기존 치료제를 1년 이상 앞설 것으로 기대되며, 아직 환자군의 절반 이상이 생존 중이어서 추후 데이터가 발표될수록 유의미한 개선 폭이 드러날 전망이다.MARIPOSA OS 최종 결과. OS의 유리한 경향성이 렉라자+리브리반트군에서 확인되고 있다. OS는 항암제의 임상적 가치를 판단하는 데 중요한 지표 중 하나다. OS는 환자가 치료를 시작해서 사망하기까지의 전체생존기간을 의미한다. 치료제의 부작용, 합병증뿐만 아니라 암 이외의 원인으로 사망한 환자들도 OS에 포함된다.안전성 측면에서 부작용 관리에 대한 임상도 병행되고 있어, 피부 이상반응을 예방적 관리로 3분의 1 줄인 중간결과가 보고됐다. 효능과 안전성을 동시에 강화하는 임상 근거가 쌓이고 있는 셈이다. EGFR 양성 표적치료제 투여 시 가장 흔하게 나타난 부작용은 피부발진이다.환자 편의성 개선을 위한 변화도 이어지고 있다. 현재 정맥주사(IV)로만 투여 가능한 리브리반트는 3주마다 병원을 방문해야 하는 불편이 있었다. 이에 얀센은 피하주사(SC) 제형 ‘리브리반트 파스프로’를 개발해 임상에 적용했으며 이미 유럽에서는 허가를 획득했다.현재 리브리반트 파스프로는 FDA 심사도 진행 중으로 올해 하반기 승인이 기대된다. SC 제형은 10분 이내 투여가 가능해 기존 6시간가량 걸리던 정맥주사 대비 환자의 시간 부담을 획기적으로 줄일 수 있다는 강점이 있다.렉라자+리브리반트 이후 아스트라제네카가 타그리소 병용요법의 가능성을 확인하는 등 향후 EGFR 양성 비소세포폐암 1차 치료제에는 병용요법이 우선 권고될 가능성이 지배적이다. 최근 미국종합암네트워크(NCCN)는 MARIPOSA 연구의 임상적 유용성을 바탕으로 EGFR 엑손 19 혹은 엑손 21 변이 비소세포폐암 1차 치료제에 렉라자+리브리반트를 권고했다.렉라자 마일스톤 2500억원 수령…R&D 재투자로 선순환 구조 확립렉라자와 리브리반트 병용요법은 국내와 미국을 비롯해 같은 해 12월 유럽 허가도 획득했다. 이 병용요법은 올해 3월 영국·일본·캐나다에도 승인됐으며 지난 7월에는 세계 최대 폐암 시장인 중국에서도 승인을 확보하며 허가국을 늘렸다.특히 매년 100만명 이상 신규 환자가 발생하는 중국은 전세계 비소세포폐암 환자의 3분의 1이 몰린 핵심 시장으로 향후 성장 잠재력이 클 것으로 전망된다. 존슨앤드존슨은 렉라자+리브리반트 병용요법의 글로벌 매출 목표를 오는 2027년 50억달러(약 7조원)로 제시한 바 있다.렉라자와 리브리반트 병용요법이 주요 시장에 자리잡으며 유한양행의 매출·이익 개선에도 연결되고 있다. 유한양행의 올해 상반기 별도 기준 매출은 1조원을 돌파했고 영업이익은 전년 대비 148% 급증했다. 회사 측은 렉라자 성과를 기반으로 한 해외사업 성장세가 이어지며 수익성이 한층 개선될 것으로 내다보고 있다.현재까지 유한양행은 렉라자 기술수출 계약금과 마일스톤으로 1억7500만달러(약 2500억원)를 수령했다.세부내역을 보면 ▲병용개발 진행(20년 4월, 3500만 달러) ▲병용 3상 투약 개시(20년 11월, 6500만 달러 ▲미국 상업화 개시(24년 9월, 6000만 달러) ▲일본 상업화 개시(25년 5월, 1500만 달러)다. 잔여 마일스톤은 7억 2500만 달러가 남아있다.렉라자의 성과는 유한양행의 R&D 선순환 구조로 연결되고 있다. 회사는 매출의 10% 이상을 매년 R&D에 투입하며, 최근 5년간 누적 투자액이 1조원을 넘어섰다. 현재 알레르기 치료제 ‘레시게르셉트’, 면역항암제 'YH32367', 희귀질환 치료제 'YH35995' 등이 차세대 파이프라인으로 부상하고 있다.유한양행의 오픈이노베이션 모델은 진화를 거듭하고 있다. 이 회사는 전임상보다 전 단계인 후보물질 탐색, 최적화 단계 등 기초과학 분야까지 확대했다.유한양행은 "렉라자 등 혁신신약의 수익을 R&D에 재투자해 신약개발을 이어나가고 있다"라며 "유한양행의 창립정신을 반영해 사회에도 기여할 수 있도록 R&D 투자 선순환 구조를 구축하겠다"라고 말했다.2025-08-19 06:19:23손형민
'렉라자' 미국 진출 1년...글로벌 시장 침투 속도유한양행 렉라자·얀센 리브리반트 [데일리팜=손형민 기자] 유한양행의 국산 폐암신약 ‘렉라자(성분명 레이저티닙, 미국 제품명 라즈클루즈)’가 미국 시장 진출 1년 만에 글로벌 시장에서 영향력을 점차적으로 확대하고 있다. 렉라자와 존슨앤드존슨의 ‘리브리반트’와 병용요법은 글로벌 매출이 빠른 속도로 증가했고 해외 진출 국가도 크게 늘었다.19일 관련 업계에 따르면 렉라자+리브리반트 병용요법은 미국 식품의약국(FDA)으로부터 허가를 획득한 이후 1년이 지났다. 해당 병용요법은 지난해 8월 FDA 허가를 받은 이후 비소세포폐암 치료제 시장에서 영향력을 크게 확대됐다. 렉라자+리브리반트는 올해 상반기에만 매출 3억2000만 달러(약 4500억원)를 기록하며 전년 같은 시점 대비 176% 늘었다.렉라자는 2021년 1월 국산 31호 신약으로 허가받은 비소세포폐암 치료제다. 국내 바이오 기업 오스코텍의 자회사 제노스코가 개발한 렉라자는 지난 2015년 유한양행에 기술이전됐다. 이후 유한양행은 2018년 11월 존슨앤드존슨 자회사 얀센과 1조4000억원 규모의 라이선스 아웃 계약을 체결했다.이후 얀센은 MARIPOSA 임상3상 연구를 통해 기존 표준치료요법(SOC)으로 활용되는 타그리소 단독요법 대비 유효성을 확인했다. 지난해 8월 19일 미국 식품의약국(FDA)은 해당 병용요법을 EGFR 양성 비소세포암 1차 치료제로 허가한 바 있다.특히 ‘표적치료제+표적치료제’ 병용이 글로벌 주요 시장에서 1차 치료제로 승인된 건 이번이 처음이라는 점에서 의의가 크다. 기존에는 백금 기반 항암화학요법과 표적치료제의 병용만 허가된 사례가 있었다. 전문가들은 렉라자+리브리반트 병용요법이 향후 EGFR 양성 비소세포폐암의 새로운 표준치료옵션으로 자리잡을 가능성이 높다고 평가한다.MARIPOSA의 최종 임상 결과, 렉라자+리브리반트군은 타그리소군 대비 통계적으로 유의한 생존율 개선을 보였다(p값 0.005 미만). 뇌전이와 관련된 지표인 두개내(intracranial) 무진행생존기간(PFS)은 렉라자+리브리반트군이 25.4개월, 타그리소군이 22.2개월로 나타났다.또 렉라자 병용요법은 전체생존기간(OS)에서 기존 치료제를 1년 이상 앞설 것으로 기대되며, 아직 환자군의 절반 이상이 생존 중이어서 추후 데이터가 발표될수록 유의미한 개선 폭이 드러날 전망이다.MARIPOSA OS 최종 결과. OS의 유리한 경향성이 렉라자+리브리반트군에서 확인되고 있다. OS는 항암제의 임상적 가치를 판단하는 데 중요한 지표 중 하나다. OS는 환자가 치료를 시작해서 사망하기까지의 전체생존기간을 의미한다. 치료제의 부작용, 합병증뿐만 아니라 암 이외의 원인으로 사망한 환자들도 OS에 포함된다.안전성 측면에서 부작용 관리에 대한 임상도 병행되고 있어, 피부 이상반응을 예방적 관리로 3분의 1 줄인 중간결과가 보고됐다. 효능과 안전성을 동시에 강화하는 임상 근거가 쌓이고 있는 셈이다. EGFR 양성 표적치료제 투여 시 가장 흔하게 나타난 부작용은 피부발진이다.환자 편의성 개선을 위한 변화도 이어지고 있다. 현재 정맥주사(IV)로만 투여 가능한 리브리반트는 3주마다 병원을 방문해야 하는 불편이 있었다. 이에 얀센은 피하주사(SC) 제형 ‘리브리반트 파스프로’를 개발해 임상에 적용했으며 이미 유럽에서는 허가를 획득했다.현재 리브리반트 파스프로는 FDA 심사도 진행 중으로 올해 하반기 승인이 기대된다. SC 제형은 10분 이내 투여가 가능해 기존 6시간가량 걸리던 정맥주사 대비 환자의 시간 부담을 획기적으로 줄일 수 있다는 강점이 있다.렉라자+리브리반트 이후 아스트라제네카가 타그리소 병용요법의 가능성을 확인하는 등 향후 EGFR 양성 비소세포폐암 1차 치료제에는 병용요법이 우선 권고될 가능성이 지배적이다. 최근 미국종합암네트워크(NCCN)는 MARIPOSA 연구의 임상적 유용성을 바탕으로 EGFR 엑손 19 혹은 엑손 21 변이 비소세포폐암 1차 치료제에 렉라자+리브리반트를 권고했다.렉라자 마일스톤 2500억원 수령…R&D 재투자로 선순환 구조 확립렉라자와 리브리반트 병용요법은 국내와 미국을 비롯해 같은 해 12월 유럽 허가도 획득했다. 이 병용요법은 올해 3월 영국·일본·캐나다에도 승인됐으며 지난 7월에는 세계 최대 폐암 시장인 중국에서도 승인을 확보하며 허가국을 늘렸다.특히 매년 100만명 이상 신규 환자가 발생하는 중국은 전세계 비소세포폐암 환자의 3분의 1이 몰린 핵심 시장으로 향후 성장 잠재력이 클 것으로 전망된다. 존슨앤드존슨은 렉라자+리브리반트 병용요법의 글로벌 매출 목표를 오는 2027년 50억달러(약 7조원)로 제시한 바 있다.렉라자와 리브리반트 병용요법이 주요 시장에 자리잡으며 유한양행의 매출·이익 개선에도 연결되고 있다. 유한양행의 올해 상반기 별도 기준 매출은 1조원을 돌파했고 영업이익은 전년 대비 148% 급증했다. 회사 측은 렉라자 성과를 기반으로 한 해외사업 성장세가 이어지며 수익성이 한층 개선될 것으로 내다보고 있다.현재까지 유한양행은 렉라자 기술수출 계약금과 마일스톤으로 1억7500만달러(약 2500억원)를 수령했다.세부내역을 보면 ▲병용개발 진행(20년 4월, 3500만 달러) ▲병용 3상 투약 개시(20년 11월, 6500만 달러 ▲미국 상업화 개시(24년 9월, 6000만 달러) ▲일본 상업화 개시(25년 5월, 1500만 달러)다. 잔여 마일스톤은 7억 2500만 달러가 남아있다.렉라자의 성과는 유한양행의 R&D 선순환 구조로 연결되고 있다. 회사는 매출의 10% 이상을 매년 R&D에 투입하며, 최근 5년간 누적 투자액이 1조원을 넘어섰다. 현재 알레르기 치료제 ‘레시게르셉트’, 면역항암제 'YH32367', 희귀질환 치료제 'YH35995' 등이 차세대 파이프라인으로 부상하고 있다.유한양행의 오픈이노베이션 모델은 진화를 거듭하고 있다. 이 회사는 전임상보다 전 단계인 후보물질 탐색, 최적화 단계 등 기초과학 분야까지 확대했다.유한양행은 "렉라자 등 혁신신약의 수익을 R&D에 재투자해 신약개발을 이어나가고 있다"라며 "유한양행의 창립정신을 반영해 사회에도 기여할 수 있도록 R&D 투자 선순환 구조를 구축하겠다"라고 말했다.2025-08-19 06:19:23손형민 -
 한미약품, 펜제형 '롤론티스 오토인젝터' 국내 허가 신청한미약품 롤론티스(미국 제품명 롤베돈)[데일리팜=손형민 기자] 한미약품은 최근 호중구감소증 치료제 롤론티스의 투여 편의성을 높인 오토인젝터(Auto-Injector, AI) 제형을 개발해 국내 품목허가신청서(NDA)를 제출했다고 18일 밝혔다.중증호중구감소증 치료제의 경우, 항암제가 골수에 미치는 악영향을 최소화하면서 호중구성장인자(G-CSF)가 효과적으로 작용할 수 있게 항암 화학요법 치료가 이뤄진 24시간 이후에 투여하도록 허가사항으로 명시돼 있다.기존 프리필드시린지 제형 피하주사제는 자가 주사가 가능하도록 허가됐지만, 주사 바늘에 대한 환자의 거부감과 사용법 오류로 인한 투여 실패의 위험 등으로 실제 자가 투여에는 어려움이 있다.이로 인해 환자가 입원하거나 추가로 병원을 방문하는 경우가 많으며, 이는 환자 편의성을 저하시킬 뿐만 아니라, 항암 치료 후의 피로감과 면역력 저하 등으로 인해 치료 순응도를 감소시키는 결과를 초래한다.한미약품이 개발 중인 오토인젝터 제형은 바늘이 보이지 않는 펜타입 주사제로, 의료진의 적절한 교육을 통해 환자 본인이 보다 쉽게 투여할 수 있도록 설계됐다.이를 통해 환자는 병원 방문 없이도 약물을 직접 투여할 수 있어 시간·경제적 부담을 줄이고, 치료 순응도를 높여 더 나은 치료 결과를 이끌어낼 것으로 기대된다.한미약품 신제품개발본부 김나영 본부장(전무)은 “롤론티스 제형 다양화는 환자 편의성을 높이는 동시에 치료 효과 향상에도 기여할 것으로 기대된다”며 “앞으로도 환자들의 삶의 질을 개선할 수 있는 혁신적인 치료 옵션을 제공하기 위해 최선을 다하겠다”고 말했다.롤론티스는 한국의 33번째 신약이자, 항암 분야 바이오신약으로 미국 식품의약국(FDA) 허가를 받은 첫 번째 제품이다. 롤베돈이란 브랜드명으로 미국 시장에 진출한 한미의 롤론티스는 미국에서 매 분기 200억원대 매출을 기록하며 한국 제약회사가 개발한 바이오신약의 위상을 높여가고 있다.2025-08-18 15:40:41손형민
한미약품, 펜제형 '롤론티스 오토인젝터' 국내 허가 신청한미약품 롤론티스(미국 제품명 롤베돈)[데일리팜=손형민 기자] 한미약품은 최근 호중구감소증 치료제 롤론티스의 투여 편의성을 높인 오토인젝터(Auto-Injector, AI) 제형을 개발해 국내 품목허가신청서(NDA)를 제출했다고 18일 밝혔다.중증호중구감소증 치료제의 경우, 항암제가 골수에 미치는 악영향을 최소화하면서 호중구성장인자(G-CSF)가 효과적으로 작용할 수 있게 항암 화학요법 치료가 이뤄진 24시간 이후에 투여하도록 허가사항으로 명시돼 있다.기존 프리필드시린지 제형 피하주사제는 자가 주사가 가능하도록 허가됐지만, 주사 바늘에 대한 환자의 거부감과 사용법 오류로 인한 투여 실패의 위험 등으로 실제 자가 투여에는 어려움이 있다.이로 인해 환자가 입원하거나 추가로 병원을 방문하는 경우가 많으며, 이는 환자 편의성을 저하시킬 뿐만 아니라, 항암 치료 후의 피로감과 면역력 저하 등으로 인해 치료 순응도를 감소시키는 결과를 초래한다.한미약품이 개발 중인 오토인젝터 제형은 바늘이 보이지 않는 펜타입 주사제로, 의료진의 적절한 교육을 통해 환자 본인이 보다 쉽게 투여할 수 있도록 설계됐다.이를 통해 환자는 병원 방문 없이도 약물을 직접 투여할 수 있어 시간·경제적 부담을 줄이고, 치료 순응도를 높여 더 나은 치료 결과를 이끌어낼 것으로 기대된다.한미약품 신제품개발본부 김나영 본부장(전무)은 “롤론티스 제형 다양화는 환자 편의성을 높이는 동시에 치료 효과 향상에도 기여할 것으로 기대된다”며 “앞으로도 환자들의 삶의 질을 개선할 수 있는 혁신적인 치료 옵션을 제공하기 위해 최선을 다하겠다”고 말했다.롤론티스는 한국의 33번째 신약이자, 항암 분야 바이오신약으로 미국 식품의약국(FDA) 허가를 받은 첫 번째 제품이다. 롤베돈이란 브랜드명으로 미국 시장에 진출한 한미의 롤론티스는 미국에서 매 분기 200억원대 매출을 기록하며 한국 제약회사가 개발한 바이오신약의 위상을 높여가고 있다.2025-08-18 15:40:41손형민 -
 TYK2억제제 개발 경쟁 가열…건선 치료 패러다임 바꿀까[데일리팜=손형민 기자] 최근 건선 치료제 시장에서 주사제를 중심으로 한 생물학적제제 개발이 주춤한 가운데, 경구용 신규 기전 치료옵션 개발이 활발해지고 있다. 기존 생물학적제제들이 이미 시장에 나온 약제들과 효과가 유사한 수준에 머무르면서 차별화된 데이터 확보에 어려움을 겪고 있기 때문이다. 반면 BMS의 소틱투 등장 이후 TYK2(Tyrosine Kinase 2) 억제제에 대한 제약업계의 관심이 집중되며 연구개발(R&D)이 가속화되고 있다.다케다 3상 긍정적…일본 가켄제약도 TYK2 억제제 확보12일 관련 업계에 따르면 다케다는 최근 신약후보물질 ‘자소시티닙’의 건선성 관절염 임상3상을 승인받고 연구를 진행 중이다.자소시티닙은 경구용 TYK2 억제제로 개발 중인 신약후보물질로, 다케다는 지난 2022년 미국 님버스 테라퓨틱스로부터 자소시티닙을 확보해 임상을 진행 중이다.TYK2는 인터루킨(IL)-23과 같은 여러 사이토카인 경로를 매개하며, IL-23은 IL-17을 포함한 전염증성 사이토카인의 생성을 유발해 각질형성세포의 증식과 표피 과증식을 촉진하게 되고 그 결과 건선을 일으키게 된다.BMS '소틱투'건선에는 종양괴사인자알파(TNF-α) 억제제, IL-억제제 등 다양한 치료옵션이 등장한 상황이다. 또 TYK2 억제제인 BMS의 소틱투 등 경구제가 등장하면서 환자 투여 편의성과 함께 치료 효과를 동시에 타깃할 수 있는 신약도 출시됐다. 소틱투는 성인 중등증-중증 판상 건선에서 최초로 승인된 TYK2 억제제다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.그중 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.HK이노엔, 가켄제약 등 아시아에서도 개발 이어나가국내를 비롯해 일본에서도 TYK2 억제제 신약에 대한 관심은 높다.일본 가켄제약은 최근 미국 생명공학회사 알루미스(Alumis)가 개발 중인 경구용 TYK2 억제제 ‘ESK-001’에 대해 일본 내 개발·제조 및 판권 라이선스 계약을 체결했다. 가켄제약은 일본에서 승인 신청 및 제품화, 필요 시 현지 임상과 개발을 담당할 예정이며, 알루미스는 일본을 포함한 다국가 공동 임상을 진행한다.올해 초 진행된 미국피부과학회 연례학술대회에서 공개된 내용에 따르면 중등증에서 중증의 판상 건선에 대해 ESK-001로 치료받은 환자들은 1년 동안 긍정적인 임상 반응을 경험했다.이 연구에서 80명의 환자가 52주차까지 1일 2회 ESK-001 40mg으로 치료를 받았다. 연구 결과를 자세히 살펴보면 PASI 90은 52주차 61.3%, 12주차 52.4%, PASI 100은 52주차 38.8%, 12주차 26.8%, 정적 PGA 0은 52주차 38.8%, 12주차 32.9%로 PASI 달성 비율이 52주차에 더 높게 나타났다.52주차까지 환자의 81.3%가 4 미만의 PASI를 경험했으며 61.3%는 0 또는 1의 DLQI(피부과 삶의 질 지수)를 보고했다.ESK-001 치료는 내약성도 양호했으며 16주 및 28주에 보고된 것과 비교해 새로운 안전성 신호를 나타내지 않았다.국내에서는 HK이노엔 임상 진입을 준비 중이다. HK이노엔은 지난해 5월 열린 미국피부과연구학회에서 알로스테릭 TYK2 저해제 'IN-121803'의 연구결과를 공개했다.'IN-121803'은 아데노신3인산(ATP) 결합부위를 공략하는 것이 아니라 TYK2 효소의 알로스테릭 결합부위를 공략해 면역, 염증 조절 단백질인 JAK 선택성을 극대화했다.HK이노엔에 따르면 현재 후보물질을 도출한 단계다. IN-121803은 FDA 승인 약물인 BMS의 듀크라바시티닙보다 JAK 선택성을 개선했고 다케다의 자소시티닙보다 더 높은 혈중 노출도와 효능을 보였다.HK이노엔은 비임상 연구를 마치는 대로 IN-121803의 임상1상시험계획(IND) 제출을 목표하고 있다.2025-08-12 12:00:45손형민
TYK2억제제 개발 경쟁 가열…건선 치료 패러다임 바꿀까[데일리팜=손형민 기자] 최근 건선 치료제 시장에서 주사제를 중심으로 한 생물학적제제 개발이 주춤한 가운데, 경구용 신규 기전 치료옵션 개발이 활발해지고 있다. 기존 생물학적제제들이 이미 시장에 나온 약제들과 효과가 유사한 수준에 머무르면서 차별화된 데이터 확보에 어려움을 겪고 있기 때문이다. 반면 BMS의 소틱투 등장 이후 TYK2(Tyrosine Kinase 2) 억제제에 대한 제약업계의 관심이 집중되며 연구개발(R&D)이 가속화되고 있다.다케다 3상 긍정적…일본 가켄제약도 TYK2 억제제 확보12일 관련 업계에 따르면 다케다는 최근 신약후보물질 ‘자소시티닙’의 건선성 관절염 임상3상을 승인받고 연구를 진행 중이다.자소시티닙은 경구용 TYK2 억제제로 개발 중인 신약후보물질로, 다케다는 지난 2022년 미국 님버스 테라퓨틱스로부터 자소시티닙을 확보해 임상을 진행 중이다.TYK2는 인터루킨(IL)-23과 같은 여러 사이토카인 경로를 매개하며, IL-23은 IL-17을 포함한 전염증성 사이토카인의 생성을 유발해 각질형성세포의 증식과 표피 과증식을 촉진하게 되고 그 결과 건선을 일으키게 된다.BMS '소틱투'건선에는 종양괴사인자알파(TNF-α) 억제제, IL-억제제 등 다양한 치료옵션이 등장한 상황이다. 또 TYK2 억제제인 BMS의 소틱투 등 경구제가 등장하면서 환자 투여 편의성과 함께 치료 효과를 동시에 타깃할 수 있는 신약도 출시됐다. 소틱투는 성인 중등증-중증 판상 건선에서 최초로 승인된 TYK2 억제제다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.그중 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.HK이노엔, 가켄제약 등 아시아에서도 개발 이어나가국내를 비롯해 일본에서도 TYK2 억제제 신약에 대한 관심은 높다.일본 가켄제약은 최근 미국 생명공학회사 알루미스(Alumis)가 개발 중인 경구용 TYK2 억제제 ‘ESK-001’에 대해 일본 내 개발·제조 및 판권 라이선스 계약을 체결했다. 가켄제약은 일본에서 승인 신청 및 제품화, 필요 시 현지 임상과 개발을 담당할 예정이며, 알루미스는 일본을 포함한 다국가 공동 임상을 진행한다.올해 초 진행된 미국피부과학회 연례학술대회에서 공개된 내용에 따르면 중등증에서 중증의 판상 건선에 대해 ESK-001로 치료받은 환자들은 1년 동안 긍정적인 임상 반응을 경험했다.이 연구에서 80명의 환자가 52주차까지 1일 2회 ESK-001 40mg으로 치료를 받았다. 연구 결과를 자세히 살펴보면 PASI 90은 52주차 61.3%, 12주차 52.4%, PASI 100은 52주차 38.8%, 12주차 26.8%, 정적 PGA 0은 52주차 38.8%, 12주차 32.9%로 PASI 달성 비율이 52주차에 더 높게 나타났다.52주차까지 환자의 81.3%가 4 미만의 PASI를 경험했으며 61.3%는 0 또는 1의 DLQI(피부과 삶의 질 지수)를 보고했다.ESK-001 치료는 내약성도 양호했으며 16주 및 28주에 보고된 것과 비교해 새로운 안전성 신호를 나타내지 않았다.국내에서는 HK이노엔 임상 진입을 준비 중이다. HK이노엔은 지난해 5월 열린 미국피부과연구학회에서 알로스테릭 TYK2 저해제 'IN-121803'의 연구결과를 공개했다.'IN-121803'은 아데노신3인산(ATP) 결합부위를 공략하는 것이 아니라 TYK2 효소의 알로스테릭 결합부위를 공략해 면역, 염증 조절 단백질인 JAK 선택성을 극대화했다.HK이노엔에 따르면 현재 후보물질을 도출한 단계다. IN-121803은 FDA 승인 약물인 BMS의 듀크라바시티닙보다 JAK 선택성을 개선했고 다케다의 자소시티닙보다 더 높은 혈중 노출도와 효능을 보였다.HK이노엔은 비임상 연구를 마치는 대로 IN-121803의 임상1상시험계획(IND) 제출을 목표하고 있다.2025-08-12 12:00:45손형민 -
![[기자의 눈] 미국발 의약품 관세, 위기와 기회 공존](https://pds.dailypharm.com/news_image/202508/325750_1.jpg) [기자의 눈] 미국발 의약품 관세, 위기와 기회 공존[데일리팜=손형민 기자] 미국 트럼프 행정부가 의약품에 관세 부과 카드를 꺼내들면서 글로벌 제약업계의 공급망이 요동치고 있다. 최근 유럽연합(EU)에서 미국으로 수출되는 의약품에 15% 관세가 부과되면서, 그간 면세 지위에 기대온 가격경쟁력 구조가 흔들리는 것이다. 산업계에선 위기와 기회가 공존하는 상황이라는 진단이 나온다.미국 식품의약국(FDA)이 최근 발표한 'FDA PreCheck' 프로그램은 이 흐름에 맞춰 미국 내 생산을 촉진하는 대표 사례다. 의약품 및 원료의약품(API) 생산의 해외 의존도를 줄이고 자국 내 생산 기반을 강화하기 위해 시설 준비와 신청 절차 과정을 대폭 단축한다는 내용이다. 해외 의존도를 낮추고 자국 내 제조 기반을 빠르게 구축하려는 의도다.기존 승인까지 통상 5~10년 걸리는 기간을 단축해 생산 가동 시점을 앞당기는 구조다. 글로벌 제약사들이 잇따라 수십억 달러 규모 투자를 발표하는 배경도 여기에 있다.글로벌 제약사들은 이미 대응에 나섰다. 사노피는 미국 내 생산 역량 강화를 위해 뉴저지 생산시설을 미국 기업 써모피셔사이언티픽에 매각했으며, 로슈는 미국 내 재고 확대를 통해 단기 공급 차질에 대비 중이다. 위탁생산 확대, 공급망 다변화, 재고 비축 등이 주요 대응 전략으로 꼽힌다.한국 기업에도 영향은 불가피하다. 지금까지는 유럽산 원료를 수입해 완제화한 뒤 미국으로 수출하거나, 유럽 제약사와 공동 개발한 제품을 직수출하는 구조가 가능했다. 하지만 15% 관세가 현실화되면 가격 경쟁력은 곤두박질친다. 특히 고가 바이오의약품이나 희귀질환 치료제처럼 가격 탄력성이 낮은 제품군은 타격이 클 수밖에 없다.셀트리온이 미국 뉴저지 일라이릴리 공장 인수를 추진하는 것도 같은 맥락이다. 현지 생산·현지 유통 구조로의 전환은 선택이 아니라 필수 조건이 되고 있다.그러나 모든 것이 부정적인 것만은 아니다. 역으로 해석하면, 미국 시장 안에서의 생산·유통 거점을 선제적으로 확보한 기업은 관세 장벽의 ‘수혜자’가 될 수 있다. 미국 정부가 제조 인프라 구축에 적극 지원 의사를 밝힌 만큼, 현지 투자와 고용 창출을 앞세운 전략은 장기적으로 안정적인 시장 지위를 보장할 수 있다. 기존 공급망 재편은 불가피하지만, 그 과정에서 기민하게 대응한 기업에게는 오히려 기회가 된다.한국은 최근 미국과의 협상에서 의약품 분야에 대해 최혜국대우(MFN)를 약속받았다. 이론적으로는 EU와 달리 관세 우대를 받을 수 있어 가격 경쟁력에서 유리한 고지를 선점할 수 있다. 다만 실질 효과는 공급망 구조에 따라 달라진다. 특히 위탁개발생산 산업은 직격탄을 맞을 가능성이 크다. 현지 원료를 쓰지 않는 한 ‘관세 우위’가 형식적 혜택에 그칠 수 있다.관세 부과는 단기적으로는 비용 상승과 공급망 불안을 불러올 수 있다. 하지만 구조 전환에 선제적으로 대응하는 기업이라면 이를 미국 시장 안착의 발판으로 삼을 수 있다. 위기와 기회의 경계선은 결국 ‘속도’와 ‘방향’에 달려 있다.결국 이번 관세 부과는 산업계에 하나의 분기점을 제시한다. 단기적으로는 원가 상승과 수익성 악화를 감수해야 하지만, 장기적으로는 글로벌 공급망에서의 입지를 재정립할 수 있는 절호의 기회이기도 하다.미국이 ‘자국 우선’ 깃발을 든 이상, 한국 기업도 ‘글로벌 현지화’라는 새로운 게임의 룰을 받아들여야 한다. 위기와 기회는 같은 문으로 들어온다. 그 문을 먼저 개방할 수 있는 기업이 승자가 될 가능성이 높다.2025-08-11 06:16:03손형민
[기자의 눈] 미국발 의약품 관세, 위기와 기회 공존[데일리팜=손형민 기자] 미국 트럼프 행정부가 의약품에 관세 부과 카드를 꺼내들면서 글로벌 제약업계의 공급망이 요동치고 있다. 최근 유럽연합(EU)에서 미국으로 수출되는 의약품에 15% 관세가 부과되면서, 그간 면세 지위에 기대온 가격경쟁력 구조가 흔들리는 것이다. 산업계에선 위기와 기회가 공존하는 상황이라는 진단이 나온다.미국 식품의약국(FDA)이 최근 발표한 'FDA PreCheck' 프로그램은 이 흐름에 맞춰 미국 내 생산을 촉진하는 대표 사례다. 의약품 및 원료의약품(API) 생산의 해외 의존도를 줄이고 자국 내 생산 기반을 강화하기 위해 시설 준비와 신청 절차 과정을 대폭 단축한다는 내용이다. 해외 의존도를 낮추고 자국 내 제조 기반을 빠르게 구축하려는 의도다.기존 승인까지 통상 5~10년 걸리는 기간을 단축해 생산 가동 시점을 앞당기는 구조다. 글로벌 제약사들이 잇따라 수십억 달러 규모 투자를 발표하는 배경도 여기에 있다.글로벌 제약사들은 이미 대응에 나섰다. 사노피는 미국 내 생산 역량 강화를 위해 뉴저지 생산시설을 미국 기업 써모피셔사이언티픽에 매각했으며, 로슈는 미국 내 재고 확대를 통해 단기 공급 차질에 대비 중이다. 위탁생산 확대, 공급망 다변화, 재고 비축 등이 주요 대응 전략으로 꼽힌다.한국 기업에도 영향은 불가피하다. 지금까지는 유럽산 원료를 수입해 완제화한 뒤 미국으로 수출하거나, 유럽 제약사와 공동 개발한 제품을 직수출하는 구조가 가능했다. 하지만 15% 관세가 현실화되면 가격 경쟁력은 곤두박질친다. 특히 고가 바이오의약품이나 희귀질환 치료제처럼 가격 탄력성이 낮은 제품군은 타격이 클 수밖에 없다.셀트리온이 미국 뉴저지 일라이릴리 공장 인수를 추진하는 것도 같은 맥락이다. 현지 생산·현지 유통 구조로의 전환은 선택이 아니라 필수 조건이 되고 있다.그러나 모든 것이 부정적인 것만은 아니다. 역으로 해석하면, 미국 시장 안에서의 생산·유통 거점을 선제적으로 확보한 기업은 관세 장벽의 ‘수혜자’가 될 수 있다. 미국 정부가 제조 인프라 구축에 적극 지원 의사를 밝힌 만큼, 현지 투자와 고용 창출을 앞세운 전략은 장기적으로 안정적인 시장 지위를 보장할 수 있다. 기존 공급망 재편은 불가피하지만, 그 과정에서 기민하게 대응한 기업에게는 오히려 기회가 된다.한국은 최근 미국과의 협상에서 의약품 분야에 대해 최혜국대우(MFN)를 약속받았다. 이론적으로는 EU와 달리 관세 우대를 받을 수 있어 가격 경쟁력에서 유리한 고지를 선점할 수 있다. 다만 실질 효과는 공급망 구조에 따라 달라진다. 특히 위탁개발생산 산업은 직격탄을 맞을 가능성이 크다. 현지 원료를 쓰지 않는 한 ‘관세 우위’가 형식적 혜택에 그칠 수 있다.관세 부과는 단기적으로는 비용 상승과 공급망 불안을 불러올 수 있다. 하지만 구조 전환에 선제적으로 대응하는 기업이라면 이를 미국 시장 안착의 발판으로 삼을 수 있다. 위기와 기회의 경계선은 결국 ‘속도’와 ‘방향’에 달려 있다.결국 이번 관세 부과는 산업계에 하나의 분기점을 제시한다. 단기적으로는 원가 상승과 수익성 악화를 감수해야 하지만, 장기적으로는 글로벌 공급망에서의 입지를 재정립할 수 있는 절호의 기회이기도 하다.미국이 ‘자국 우선’ 깃발을 든 이상, 한국 기업도 ‘글로벌 현지화’라는 새로운 게임의 룰을 받아들여야 한다. 위기와 기회는 같은 문으로 들어온다. 그 문을 먼저 개방할 수 있는 기업이 승자가 될 가능성이 높다.2025-08-11 06:16:03손형민 -
 젭바운드, 2분기 글로벌 매출 5조원…위고비 첫 추월[데일리팜=손형민 기자] 일라이릴리의 GLP-1 계열 비만약 젭바운드가 출시 후 매출 고공행진을 이어나가며 위고비를 넘어섰다. 젭바운드는 전년 대비 매출이 160% 늘며 분기 매출 5조원을 기록했다. 위고비도 지난해보다 매출이 67% 증가했지만 젭바운드의 성장세에는 미치지 못했다.9일 일라이릴리 실적 자료에 따르면 이 회사의 지난 2분기 매출은 155억5700만 달러(약 22조원)로, 전년 대비 38% 증가했다. 회사의 상반기 매출은 282억8600만 달러(약 39조원)를 기록하며 지난해보다 41% 늘었다.릴리의 실적은 GLP-1 계열 신약들이 견인했다. 당뇨병 치료제 마운자로는 올해 2분기 51억9800만 달러(약 7조원)를 올리며 지난해보다 68% 늘었다. 동일 성분 비만 치료제 젭바운드는 33억8100만 달러(약 4조7000억원)로 전년 동기 대비 172% 증가했다. 마운자로와 젭바운드의 매출은 릴리 실적의 30%를 차지했다.젭바운드는 2분기 들어 위고비의 매출 195억2800만 덴마크크로네(약 4조2000억원)를 처음으로 넘어섰다. 마운자로는 릴리가 개발한 당뇨병 신약이다. 이 치료제는 인슐린 분비 자극 펩타이드(GIP) 수용체와 글루카곤 유사 펩타이드(GLP-1) 수용체에 모두 작용해 인슐린 분비 촉진, 인슐린 저항성 개선, 글루카곤 분비 감소 등으로 식전과 식후 혈당 감소를 유도한다.마운자로는 혈당조절뿐 아니라 체중감량 효과가 뛰어나다는 장점이 있다. 마운자로는 주 1회 투여 만으로 당뇨병이 없고 체질량지수(BMI)가 30kg/㎡ 이상이거나 동반질환이 하나 이상 있는 과체중 성인환자를 대상으로 진행한 SURMOUNT-1 임상3상 결과를 통해 체중 감소 효과를 입증했다.릴리는 마운자로의 임상에서 체중 감량 효과를 확인한 만큼 동일 성분 비만치료제 젭바운드를 지난 2023년 11월 미국 시장에 출시한 바 있다. 국내에서 마운자로는 2023년 6월 당뇨병 치료제로 허가됐고 지난해 8월에는 동일 제품명 비만신약으로 추가 적응증을 확보했다.젭바운드는 2023년 4분기 출시된 이후 성장세를 지속 이어나갔다. 젭바운드의 지난해 1분기 매출은 5억1700만 달러였으나 올해 1분기에는 23억1200만 달러로 347% 수직상승했다. 젭바운드는 출시 후 누적 매출 107억9400만 달러(약 15조원)를 올렸다.릴리는 기존 치료제보다 더 큰 젭바운드의 체중감량 효과에 기대를 걸고 있다. 젭바운드는 위고비와의 직접 비교 임상인 SURMOUNT-5에서도 체중 감량 효과의 우위를 나타냈다. 임상 결과, 1차 평가변수에서 마운자로 투여군(10mg 또는 15mg)의 72주차 기준 평균 체중 감소율은 20.2%로, 위고비 투여군(1.7mg 또는 2.4mg)의 13.7%와 비교해 상대적으로 더 개선된 체중 감소율을 달성했다.현재 릴리는 북미 시장 외에도 다양한 국가에서 젭바운드를 출시 준비 중에 있다. 국내에서는 이달 중순 출시가 예고됐다.비만치료제 위고비·젭바운드·삭센다 위고비 누적 매출 29조원…비만약 시장 성장세 이어나가노보노디스크의 GLP-1 제제 비만신약 위고비도 성장세를 이어나갔다. 노보노디스크의 상반기 매출은 1549억4400만 덴마크크로네(약 33조5000억원)로 전년 동기 대비 16% 늘었다. 같은 기간 영업이익은 577억8000만 덴마크크로네에서 722억400만 덴마크크로네로 25% 증가했다.노보노디스크의 실적 대부분은 당뇨병, 비만, 인슐린 등 대사 질환 약제들의 매출로 구성됐다. 당뇨병 치료제 오젬픽과 리벨서스, 빅토자를 비롯해 위고비, 삭센다 등 비만 치료제, 인슐린 등 대사 질환 제품들의 매출 합산은 1454억1000만 덴마크크로네로 회사 매출의 94%를 차지한다. 그중 성장세가 두드러지는 품목은 비만치료제 위고비다. 위고비는 세마글루타이드 성분 GLP-1 계열 비만치료제다. 노보노디스크는 보유하고 있는 GLP-1 계열 당뇨병 치료제 후보물질들의 임상 도중 환자 체중 감량 효과를 확인했다. 이에 세마글루타이드 성분으로 비만치료제 위고비를, 리라글루타이드 성분으로 삭센다를 개발해 냈다.위고비의 2분기 매출은 195억2800만 덴마크크로네(약 4조2000억원)로 전년 동기 대비 67% 늘었다. 상반기 합산 매출은 368억8800만 덴마크크로네를 기록하며 지난해보다 75% 증가했다. 상반기 기준 위고비의 매출 점유율은 24%였다.위고비는 2021년 2분기 시장에 등장한 매출이 폭발적으로 늘어났다. 위고비는 2022년 1분기 매출 14억400만 덴마크크로네(약 3000억원)를 기록한 이후 이듬해 1분기 45억6300만 덴마크크로네(약 1조원)를 기록하며 225% 늘었다. 지난해 2분기엔 매출 100억 덴마크크로네(약 2조원)을 돌파한 이후 3분기 173억400만 덴마크크로네, 4분기에는 198억6600만 덴마크크로네를 기록하며 매출이 지속 늘어났다.출시 이후 누적 매출은 1340억1100만 덴마크크로네(약 29조원)로, 글로벌 초대형 블록버스터 의약품으로 거듭났다.다만 위고비, 오젬픽 등 GLP-1 제제들은 젭바운드, 마운자로 등 경쟁 제품들의 선전으로 기대 증가세 대비 미치지 못했다는 평가도 나온다. 노보노디스크는 "북미 시장에서 GLP-1 제제들의 성장세 기대치가 줄어들었다. 또 전 세기 시장에서 위고비의 시장 침투율이 기대에 미치지 못하고 있다”고 설명했다.노보노디스크는 연간 실적 예상치를 기존보다 하향 조정했다. 회사는 올해 연매출 성장률이 최대 21% 성장할 것이라 내다봤지만, 2분기 실적 공개와 함께 최대 14%로 수치를 낮췄다.2025-08-09 06:00:00손형민
젭바운드, 2분기 글로벌 매출 5조원…위고비 첫 추월[데일리팜=손형민 기자] 일라이릴리의 GLP-1 계열 비만약 젭바운드가 출시 후 매출 고공행진을 이어나가며 위고비를 넘어섰다. 젭바운드는 전년 대비 매출이 160% 늘며 분기 매출 5조원을 기록했다. 위고비도 지난해보다 매출이 67% 증가했지만 젭바운드의 성장세에는 미치지 못했다.9일 일라이릴리 실적 자료에 따르면 이 회사의 지난 2분기 매출은 155억5700만 달러(약 22조원)로, 전년 대비 38% 증가했다. 회사의 상반기 매출은 282억8600만 달러(약 39조원)를 기록하며 지난해보다 41% 늘었다.릴리의 실적은 GLP-1 계열 신약들이 견인했다. 당뇨병 치료제 마운자로는 올해 2분기 51억9800만 달러(약 7조원)를 올리며 지난해보다 68% 늘었다. 동일 성분 비만 치료제 젭바운드는 33억8100만 달러(약 4조7000억원)로 전년 동기 대비 172% 증가했다. 마운자로와 젭바운드의 매출은 릴리 실적의 30%를 차지했다.젭바운드는 2분기 들어 위고비의 매출 195억2800만 덴마크크로네(약 4조2000억원)를 처음으로 넘어섰다. 마운자로는 릴리가 개발한 당뇨병 신약이다. 이 치료제는 인슐린 분비 자극 펩타이드(GIP) 수용체와 글루카곤 유사 펩타이드(GLP-1) 수용체에 모두 작용해 인슐린 분비 촉진, 인슐린 저항성 개선, 글루카곤 분비 감소 등으로 식전과 식후 혈당 감소를 유도한다.마운자로는 혈당조절뿐 아니라 체중감량 효과가 뛰어나다는 장점이 있다. 마운자로는 주 1회 투여 만으로 당뇨병이 없고 체질량지수(BMI)가 30kg/㎡ 이상이거나 동반질환이 하나 이상 있는 과체중 성인환자를 대상으로 진행한 SURMOUNT-1 임상3상 결과를 통해 체중 감소 효과를 입증했다.릴리는 마운자로의 임상에서 체중 감량 효과를 확인한 만큼 동일 성분 비만치료제 젭바운드를 지난 2023년 11월 미국 시장에 출시한 바 있다. 국내에서 마운자로는 2023년 6월 당뇨병 치료제로 허가됐고 지난해 8월에는 동일 제품명 비만신약으로 추가 적응증을 확보했다.젭바운드는 2023년 4분기 출시된 이후 성장세를 지속 이어나갔다. 젭바운드의 지난해 1분기 매출은 5억1700만 달러였으나 올해 1분기에는 23억1200만 달러로 347% 수직상승했다. 젭바운드는 출시 후 누적 매출 107억9400만 달러(약 15조원)를 올렸다.릴리는 기존 치료제보다 더 큰 젭바운드의 체중감량 효과에 기대를 걸고 있다. 젭바운드는 위고비와의 직접 비교 임상인 SURMOUNT-5에서도 체중 감량 효과의 우위를 나타냈다. 임상 결과, 1차 평가변수에서 마운자로 투여군(10mg 또는 15mg)의 72주차 기준 평균 체중 감소율은 20.2%로, 위고비 투여군(1.7mg 또는 2.4mg)의 13.7%와 비교해 상대적으로 더 개선된 체중 감소율을 달성했다.현재 릴리는 북미 시장 외에도 다양한 국가에서 젭바운드를 출시 준비 중에 있다. 국내에서는 이달 중순 출시가 예고됐다.비만치료제 위고비·젭바운드·삭센다 위고비 누적 매출 29조원…비만약 시장 성장세 이어나가노보노디스크의 GLP-1 제제 비만신약 위고비도 성장세를 이어나갔다. 노보노디스크의 상반기 매출은 1549억4400만 덴마크크로네(약 33조5000억원)로 전년 동기 대비 16% 늘었다. 같은 기간 영업이익은 577억8000만 덴마크크로네에서 722억400만 덴마크크로네로 25% 증가했다.노보노디스크의 실적 대부분은 당뇨병, 비만, 인슐린 등 대사 질환 약제들의 매출로 구성됐다. 당뇨병 치료제 오젬픽과 리벨서스, 빅토자를 비롯해 위고비, 삭센다 등 비만 치료제, 인슐린 등 대사 질환 제품들의 매출 합산은 1454억1000만 덴마크크로네로 회사 매출의 94%를 차지한다. 그중 성장세가 두드러지는 품목은 비만치료제 위고비다. 위고비는 세마글루타이드 성분 GLP-1 계열 비만치료제다. 노보노디스크는 보유하고 있는 GLP-1 계열 당뇨병 치료제 후보물질들의 임상 도중 환자 체중 감량 효과를 확인했다. 이에 세마글루타이드 성분으로 비만치료제 위고비를, 리라글루타이드 성분으로 삭센다를 개발해 냈다.위고비의 2분기 매출은 195억2800만 덴마크크로네(약 4조2000억원)로 전년 동기 대비 67% 늘었다. 상반기 합산 매출은 368억8800만 덴마크크로네를 기록하며 지난해보다 75% 증가했다. 상반기 기준 위고비의 매출 점유율은 24%였다.위고비는 2021년 2분기 시장에 등장한 매출이 폭발적으로 늘어났다. 위고비는 2022년 1분기 매출 14억400만 덴마크크로네(약 3000억원)를 기록한 이후 이듬해 1분기 45억6300만 덴마크크로네(약 1조원)를 기록하며 225% 늘었다. 지난해 2분기엔 매출 100억 덴마크크로네(약 2조원)을 돌파한 이후 3분기 173억400만 덴마크크로네, 4분기에는 198억6600만 덴마크크로네를 기록하며 매출이 지속 늘어났다.출시 이후 누적 매출은 1340억1100만 덴마크크로네(약 29조원)로, 글로벌 초대형 블록버스터 의약품으로 거듭났다.다만 위고비, 오젬픽 등 GLP-1 제제들은 젭바운드, 마운자로 등 경쟁 제품들의 선전으로 기대 증가세 대비 미치지 못했다는 평가도 나온다. 노보노디스크는 "북미 시장에서 GLP-1 제제들의 성장세 기대치가 줄어들었다. 또 전 세기 시장에서 위고비의 시장 침투율이 기대에 미치지 못하고 있다”고 설명했다.노보노디스크는 연간 실적 예상치를 기존보다 하향 조정했다. 회사는 올해 연매출 성장률이 최대 21% 성장할 것이라 내다봤지만, 2분기 실적 공개와 함께 최대 14%로 수치를 낮췄다.2025-08-09 06:00:00손형민 -
 첫 TYK2 억제제 '소틱투', 아시아 건선 환자서도 효과한국BMS제약 '소틱투' [데일리팜=손형민 기자] 한국BMS제약과 유한양행이 국내에서 공동 판매 중인 건선 치료제 소틱투가 동아시아 환자 데이터를 축적하며 국내 건선 환자 맞춤형 경구 치료 옵션으로 자리매김하고 있다. 소틱투는 두피·손발톱 등 치료가 어려운 특수부위에서도 유효성을 입증했고 건강보험 일반급여 적용으로 환자들의 조기 치료 접근성도 높였다는 평가다.8일 관련 업계에 따르면 BMS는 최근 한국인이 포함된 동아시아 환자의 임상 데이터를 공개했다. 소틱투는 최초(first-in-class)의 선택적 TYK2 억제제로 다른 JAK 억제제와 달리 비활성 조절 도메인에 결합하는 알로스테릭(allosteric) 기전을 갖고 있다.건선은 완치가 어렵고 증상의 호전과 악화를 반복하는 만성 질환으로, 장기적이고 지속적인 치료가 필요하다. 특히 환자 개개인의 질환 양상과 치료 선호도에 따라 다양한 치료 옵션이 요구돼 새로운 대안에 대한 치료적 요구가 존재했다.소틱투는 식사와 관계없이 1일 1회, 용량 조절 없이 경구 복용하는 치료제로, 기존 보편적 치료 옵션 외 선택지가 생물학적제제밖에 없던 상황에서 건선 환자의 선택권을 확대시켰다.소틱투는 다수의 글로벌, 아시아 임상시험을 통해 건선 치료의 효과와 안전성 프로파일을 입증받았다. 기존 한국인을 포함한 아시아 환자군 대상 POETYK PSO-3 연구에서 투약 16주 차 건선 중증도 지수(PASI) 75 반응률은 68.8%, 의사의 전반적 평가(sPGA) 0/1 달성률은 55.6%로, 위약군 대비 유의한 개선을 보였다.최근 일본에서 진행된 세 건의 분석 결과도 동아시아인 대상 소틱투의치료 효과와 안전성을 뒷받침했다. ▲POETYK PSO-4 3상 임상 사후 분석▲POETYK PSO-1·4·LTE 연구를 통한 일본인 대상 3년 유효성·안전성 분석▲POETYK PSO-4 일본인 환자 보고 결과 분석 등 올해 세로운 데이터가 공개됐다.일본 환자를 대상으로 한 POETYK PSO-4 사후 분석에서 소틱투 투여군의 치료 16주 차 PASI 2 이하 도달률은 46.0%, 52주 차에는 PASI 2 이하 68.3%, PASI 1 이하는 47.6%로 확인됐다.같은 연구의 환자 보고 지표(PRO) 분석에서는 52주 차 DLQI(피부과 삶의 질 지수) 0/1 도달률이 66.1%에 달했다.병변의 홍반, 각질 두께, 각질 심한 정도 등 주요 증상은 치료 1주 차부터 개선되기 시작해 16주 차까지 80% 이상 호전됐고, 52주 차까지 약 90%가량 효과가 유지되거나 향상됐다.정기헌 경희대학교병원 피부과 교수(대한건선학회 보험이사)는 “두피나 손발바닥처럼 겉으로 드러나고 일상에 불편을 주는 부위는 증상이 경미해도 환자 만족도가 낮은 경우가 많다”며 “특수부위까지 효과가 확인된 경구제는 치료 선택의 폭을 넓혀줄 수 있을 것으로 기대한다”고 전했다.건강보험 적용으로 치료비 부담 크게 완화, 최신 치료 접근성 높여소틱투는 다양한 기존 치료 이력을 가진 환자에서도 일관된 효과를 보이며 장기 치료 옵션으로 가능성을 보였다.POETYK PSO-1, PSO-4, 장기 연장 연구(LTE)를 포함한 3년 사후 분석에서 일본인 환자 125명 중 65.6%가 기존 치료 경험이 있었고, 이 중 20.8%는 생물학적제제 사용 이력이 있었다.PSO-1 일본인 환자 분석에서는 1년 차 PASI 달성률이 88.9%, 3년 차 87.5%로 유지됐으며, sPGA 0/1 반응률도 1년 차 74.1%에서 3년 차 66.7%로 장기 반응이 지속됐다.위약에서 소틱투로 전환된 환자군에서도 유사한 결과가 나타났다. 이는 기존 치료 경험과 무관하게 장기간 일관된 임상 반응이 가능함을 시사한다.소틱투는 2023년 국내 허가를 받았으며, 이듬해 일반급여로 건강보험이 적용되며 기존 치료제 대비 환자 접근성과 비용부담을 크게 낮췄다. 건강보험 급여 기준에 따라 6개월 이상 지속된 만성 중증 판상 건선을 앓는 만 18세 이상 성인 환자에게 투여할 수 있다.소틱투는 2023년 국내 식품의약품안전처 허가 후 8개월 만에 건강보험 일반급여가 적용됐다. 급여 기준은 6개월 이상 지속된 만성 중증 판상 건선을 앓는 만 18세 이상 성인 환자 가운데 ▲BSA(체표면적) 10% 이상 ▲PASI 10 이상인 경우 중 △메토트렉세이트·사이클로스포린 3개월 이상 사용에도 반응이 없거나 부작용으로 지속 불가한 경우 △광화학요법·중파장자외선 치료 3개월 이상에도 반응이 없거나 부작용으로 지속 불가한 경우다.정기헌 교수는 “동아시아인을 대상으로 한 근거가 축적되는 것은 국내 건선 치료 환경에 고무적”이라며 “급여 적용으로 치료비 부담이 줄어, 산정특례에 해당하지 않아도 빠르고 경제적인 치료가 가능해졌다. 많은 환자들에게 실질적인 치료 기회를 제공할 수 있을 것”이라고 말했다.2025-08-08 12:00:00손형민
첫 TYK2 억제제 '소틱투', 아시아 건선 환자서도 효과한국BMS제약 '소틱투' [데일리팜=손형민 기자] 한국BMS제약과 유한양행이 국내에서 공동 판매 중인 건선 치료제 소틱투가 동아시아 환자 데이터를 축적하며 국내 건선 환자 맞춤형 경구 치료 옵션으로 자리매김하고 있다. 소틱투는 두피·손발톱 등 치료가 어려운 특수부위에서도 유효성을 입증했고 건강보험 일반급여 적용으로 환자들의 조기 치료 접근성도 높였다는 평가다.8일 관련 업계에 따르면 BMS는 최근 한국인이 포함된 동아시아 환자의 임상 데이터를 공개했다. 소틱투는 최초(first-in-class)의 선택적 TYK2 억제제로 다른 JAK 억제제와 달리 비활성 조절 도메인에 결합하는 알로스테릭(allosteric) 기전을 갖고 있다.건선은 완치가 어렵고 증상의 호전과 악화를 반복하는 만성 질환으로, 장기적이고 지속적인 치료가 필요하다. 특히 환자 개개인의 질환 양상과 치료 선호도에 따라 다양한 치료 옵션이 요구돼 새로운 대안에 대한 치료적 요구가 존재했다.소틱투는 식사와 관계없이 1일 1회, 용량 조절 없이 경구 복용하는 치료제로, 기존 보편적 치료 옵션 외 선택지가 생물학적제제밖에 없던 상황에서 건선 환자의 선택권을 확대시켰다.소틱투는 다수의 글로벌, 아시아 임상시험을 통해 건선 치료의 효과와 안전성 프로파일을 입증받았다. 기존 한국인을 포함한 아시아 환자군 대상 POETYK PSO-3 연구에서 투약 16주 차 건선 중증도 지수(PASI) 75 반응률은 68.8%, 의사의 전반적 평가(sPGA) 0/1 달성률은 55.6%로, 위약군 대비 유의한 개선을 보였다.최근 일본에서 진행된 세 건의 분석 결과도 동아시아인 대상 소틱투의치료 효과와 안전성을 뒷받침했다. ▲POETYK PSO-4 3상 임상 사후 분석▲POETYK PSO-1·4·LTE 연구를 통한 일본인 대상 3년 유효성·안전성 분석▲POETYK PSO-4 일본인 환자 보고 결과 분석 등 올해 세로운 데이터가 공개됐다.일본 환자를 대상으로 한 POETYK PSO-4 사후 분석에서 소틱투 투여군의 치료 16주 차 PASI 2 이하 도달률은 46.0%, 52주 차에는 PASI 2 이하 68.3%, PASI 1 이하는 47.6%로 확인됐다.같은 연구의 환자 보고 지표(PRO) 분석에서는 52주 차 DLQI(피부과 삶의 질 지수) 0/1 도달률이 66.1%에 달했다.병변의 홍반, 각질 두께, 각질 심한 정도 등 주요 증상은 치료 1주 차부터 개선되기 시작해 16주 차까지 80% 이상 호전됐고, 52주 차까지 약 90%가량 효과가 유지되거나 향상됐다.정기헌 경희대학교병원 피부과 교수(대한건선학회 보험이사)는 “두피나 손발바닥처럼 겉으로 드러나고 일상에 불편을 주는 부위는 증상이 경미해도 환자 만족도가 낮은 경우가 많다”며 “특수부위까지 효과가 확인된 경구제는 치료 선택의 폭을 넓혀줄 수 있을 것으로 기대한다”고 전했다.건강보험 적용으로 치료비 부담 크게 완화, 최신 치료 접근성 높여소틱투는 다양한 기존 치료 이력을 가진 환자에서도 일관된 효과를 보이며 장기 치료 옵션으로 가능성을 보였다.POETYK PSO-1, PSO-4, 장기 연장 연구(LTE)를 포함한 3년 사후 분석에서 일본인 환자 125명 중 65.6%가 기존 치료 경험이 있었고, 이 중 20.8%는 생물학적제제 사용 이력이 있었다.PSO-1 일본인 환자 분석에서는 1년 차 PASI 달성률이 88.9%, 3년 차 87.5%로 유지됐으며, sPGA 0/1 반응률도 1년 차 74.1%에서 3년 차 66.7%로 장기 반응이 지속됐다.위약에서 소틱투로 전환된 환자군에서도 유사한 결과가 나타났다. 이는 기존 치료 경험과 무관하게 장기간 일관된 임상 반응이 가능함을 시사한다.소틱투는 2023년 국내 허가를 받았으며, 이듬해 일반급여로 건강보험이 적용되며 기존 치료제 대비 환자 접근성과 비용부담을 크게 낮췄다. 건강보험 급여 기준에 따라 6개월 이상 지속된 만성 중증 판상 건선을 앓는 만 18세 이상 성인 환자에게 투여할 수 있다.소틱투는 2023년 국내 식품의약품안전처 허가 후 8개월 만에 건강보험 일반급여가 적용됐다. 급여 기준은 6개월 이상 지속된 만성 중증 판상 건선을 앓는 만 18세 이상 성인 환자 가운데 ▲BSA(체표면적) 10% 이상 ▲PASI 10 이상인 경우 중 △메토트렉세이트·사이클로스포린 3개월 이상 사용에도 반응이 없거나 부작용으로 지속 불가한 경우 △광화학요법·중파장자외선 치료 3개월 이상에도 반응이 없거나 부작용으로 지속 불가한 경우다.정기헌 교수는 “동아시아인을 대상으로 한 근거가 축적되는 것은 국내 건선 치료 환경에 고무적”이라며 “급여 적용으로 치료비 부담이 줄어, 산정특례에 해당하지 않아도 빠르고 경제적인 치료가 가능해졌다. 많은 환자들에게 실질적인 치료 기회를 제공할 수 있을 것”이라고 말했다.2025-08-08 12:00:00손형민 -
 국내 상륙 '마운자로'…'위고비'와 유통 맞대결 예고[데일리팜=손형민 기자] 한국릴리의 당뇨병·비만 치료제 마운자로가 이달 중순 등장을 예고하면서 노보노디스크의 위고비와 본격 경쟁 구도가 형성될 전망이다.릴리는 마운자로의 직접 유통을 진행할 예정으로, 공동판매사를 물색하고 있는 노보노디스크의 판매 전략과 차별화를 뒀다.8일 유통업계에 따르면 한국릴리는 이달 마운자로를 국내 출시할 예정이다. 한국릴리는 자체 영업, 마케팅 인력을 꾸리고 거래 중인 유통사를 통해 한국 시장에 도전장을 내밀었다. 출시는 8월 셋째 주가 유력하다.마운자로의 국내 공급가는 2.5mg 27만8066원, 5mg 36만9307원, 7.5mg과 10mg은 52만1377원에 유통될 것으로 알려졌다. 이달 국내 출시될 제형은 2.5mg과 5mg이다.마운자로는 주 1회 투여하는 피하주사 제형으로, 2.5㎎로 시작해 4주 간격으로 투여 용량을 증량해야 한다. 최대 용량은 15mg이다.한국릴리 관계자는 “8월 셋째 주 마운자로의 국내 출시를 목표로 준비 중이다. 마운자로는 우선적으로 2.5mg, 5mg만 국내 선보일 계획이지만, 환자 수요도에 맞게 향후 7.5mg, 10mg, 12.5mg, 15mg 등 고용량 제형도 차질없이 공급할 예정”이라고 말했다.비만치료제 위고비, 젭바운드, 삭센다 한국릴리와 노보노디스크는 마운자로와 위고비 유통 방식에 차별화를 뒀다.최근 한국릴리는 국내 최대 의약품 유통업체인 지오영을 포함해 30여 곳의 수도권, 지방 거점 의약품 유통업체들과 계약 논의를 시작했다. 계약은 마무리 단계에 접어들었으며 서울은 12곳에서 15곳, 지방은 10곳에서 14곳 사이의 의약품 유통업체들과 논의가 진행되고 있는 것으로 알려진다.한국릴리는 이번 마운자로 유통 전략에 있어 유통업체가 직접 요양기관에 납품하는 구조를 채택했다. 제약사는 공급가격까지만 개입하며 실제 거래가는 유통업체 자율에 맡기고 ‘너무 비싸지도, 너무 싸지도 않게’ 판매할 수 있도록 일정한 가격 가이드를 둔 것으로 전해졌다.한국릴리는 트루리시티 등 기존 GLP-1 약제들을 국내 공급했던 경험이 있는 만큼 직접 유통에서도 경쟁력을 확보할 수 있다는 생각이다.노보노디스크의 경우 현재 외국계 의약품 유통업체 쥴릭파마를 통해 위고비의 전국 유통을 맡기고 있으며, 블루엠텍 등 일부 유통 업체를 통해 요양기관에 공급하고 있다.최근에는 노보노디스크와 국내 제약사 종근당이 위고비의 공동판매를 진행할 것이라는 이야기도 나오고 있다. 종근당은 알보젠코리아의 비만약 ‘큐시미아’를 국내 판매한 경험이 있다. 다만 회사에 따르면 아직까지 확정된 사안은 없다.시장 관심은 마운자로가 위고비의 기세를 얼마나 꺾을 수 있을지에 쏠리고 있다. 위고비는 국내 정식 출시가 지연되는 와중에도, 일부 채널을 통해 유통되며 시장을 빠르게 잠식해 나갔다.시장조사기관 아이큐비아에 따르면 올해 1분기 위고비의 매출은 794억원을 기록했다. 전체 비만약 시장에서 위고비의 점유율은 73.2%에 달했다.세마글루타이드 성분 GLP-1 단일제인 위고비는 지난해 10월 국내 출시 직후부터 선풍적인 인기를 끌었다. 비싼 가격에도 높은 체중 감량 효과로 처방 수요가 급증했다. 위고비는 작년 4분기 매출 603억원을 올리며 단숨에 비만약 시장 선두에 올라섰다. 지난해 3분기 비만약 시장 규모는 474억원을 기록했는데 위고비 출시로 1분기 만에 938억원으로 97.9% 치솟았다.마운자로, 위고비보다 더 큰 체중감량 효과 입증한국릴리는 기존 치료제보다 더 큰 마운자로의 체중감량 효과에 기대를 걸고 있다. 마운자로는 인슐린 분비 자극 펩타이드(GIP) 수용체와 글루카곤 유사 펩타이드-1(GLP-1) 수용체에 모두 작용해 인슐린 분비 촉진, 인슐린 저항성 개선, 글루카곤 분비 감소 등으로 식전과 식후 혈당 감소를 유도한다.주요 당뇨병·비만 환자들은 인크레틴이 저하되는데 GLP-1 분비 감소와 GIP 인슐린 자극 효과의 장애가 주요 원인으로 꼽힌다. GLP-1과 GIP는 식후 인슐린 반응의 3분의 2를 책임지고 있는 호르몬이다.당뇨병, 비만치료제 '마운자로' 마운자로는 국내에서 성인 2형 당뇨병 환자의 혈당 조절 개선을 위한 식이요법과 운동요법의 보조제 및 성인 비만(초기 체질량지수(BMI)≥30kg/㎡) 환자, 또는 한 가지 체중 관련 동반질환(고혈압, 이상지질혈증, 제2형 당뇨병, 폐쇄성 수면 무호흡 또는 심혈관 질환)이 있는 과체중(초기 BMI 27kg/㎡ 이상, 30kg/㎡ 미만) 환자의 만성 체중 관리를 위한 저칼로리 식이요법 및 운동요법의 보조제로 허가됐다.마운자로는 혈당조절뿐 아니라 체중감량 효과가 뛰어나다는 장점이 있다. 마운자로는 주 1회 투여 만으로 당뇨병이 없고 BMI가 30kg/㎡ 이상이거나 동반질환이 하나 이상 있는 과체중 성인환자를 대상으로 진행한 SURMOUNT-1 임상3상 결과를 통해 체중 감소 효과를 입증했다.해당 임상에서 치료 72주째 마운자로 투여군은 평균 15% 이상의 체중 감소가 나타난 것으로 확인됐다. 가장 높은 용량을 투여한 군은 체중의 21%를 감량했다.특히 마운자로는 위고비와의 직접 비교 임상인 SURMOUNT-5에서도 체중 감량 효과의 우위를 나타냈다.임상 결과, 1차 평가변수에서 마운자로 투여군(10mg 또는 15mg)의 72주차 기준 평균 체중 감소율은 20.2%로, 위고비 투여군(1.7mg 또는 2.4mg)의 13.7%와 비교해 상대적으로 더 개선된 체중 감소율을 달성했다.릴리는 마운자로의 임상에서 체중 감량 효과를 확인한 만큼 동일 성분 비만치료제 젭바운드를 지난 2023년 11월 미국 시장에 출시한 바 있다. 국내에서는 당뇨병과 비만 적응증 모두 제품명 마운자로를 통해 유통된다.한국릴리는 마운자로의 2형 당뇨병 적응증을 통해 보험급여 신청에도 나서겠다는 계획이다.2025-08-08 06:00:00손형민
국내 상륙 '마운자로'…'위고비'와 유통 맞대결 예고[데일리팜=손형민 기자] 한국릴리의 당뇨병·비만 치료제 마운자로가 이달 중순 등장을 예고하면서 노보노디스크의 위고비와 본격 경쟁 구도가 형성될 전망이다.릴리는 마운자로의 직접 유통을 진행할 예정으로, 공동판매사를 물색하고 있는 노보노디스크의 판매 전략과 차별화를 뒀다.8일 유통업계에 따르면 한국릴리는 이달 마운자로를 국내 출시할 예정이다. 한국릴리는 자체 영업, 마케팅 인력을 꾸리고 거래 중인 유통사를 통해 한국 시장에 도전장을 내밀었다. 출시는 8월 셋째 주가 유력하다.마운자로의 국내 공급가는 2.5mg 27만8066원, 5mg 36만9307원, 7.5mg과 10mg은 52만1377원에 유통될 것으로 알려졌다. 이달 국내 출시될 제형은 2.5mg과 5mg이다.마운자로는 주 1회 투여하는 피하주사 제형으로, 2.5㎎로 시작해 4주 간격으로 투여 용량을 증량해야 한다. 최대 용량은 15mg이다.한국릴리 관계자는 “8월 셋째 주 마운자로의 국내 출시를 목표로 준비 중이다. 마운자로는 우선적으로 2.5mg, 5mg만 국내 선보일 계획이지만, 환자 수요도에 맞게 향후 7.5mg, 10mg, 12.5mg, 15mg 등 고용량 제형도 차질없이 공급할 예정”이라고 말했다.비만치료제 위고비, 젭바운드, 삭센다 한국릴리와 노보노디스크는 마운자로와 위고비 유통 방식에 차별화를 뒀다.최근 한국릴리는 국내 최대 의약품 유통업체인 지오영을 포함해 30여 곳의 수도권, 지방 거점 의약품 유통업체들과 계약 논의를 시작했다. 계약은 마무리 단계에 접어들었으며 서울은 12곳에서 15곳, 지방은 10곳에서 14곳 사이의 의약품 유통업체들과 논의가 진행되고 있는 것으로 알려진다.한국릴리는 이번 마운자로 유통 전략에 있어 유통업체가 직접 요양기관에 납품하는 구조를 채택했다. 제약사는 공급가격까지만 개입하며 실제 거래가는 유통업체 자율에 맡기고 ‘너무 비싸지도, 너무 싸지도 않게’ 판매할 수 있도록 일정한 가격 가이드를 둔 것으로 전해졌다.한국릴리는 트루리시티 등 기존 GLP-1 약제들을 국내 공급했던 경험이 있는 만큼 직접 유통에서도 경쟁력을 확보할 수 있다는 생각이다.노보노디스크의 경우 현재 외국계 의약품 유통업체 쥴릭파마를 통해 위고비의 전국 유통을 맡기고 있으며, 블루엠텍 등 일부 유통 업체를 통해 요양기관에 공급하고 있다.최근에는 노보노디스크와 국내 제약사 종근당이 위고비의 공동판매를 진행할 것이라는 이야기도 나오고 있다. 종근당은 알보젠코리아의 비만약 ‘큐시미아’를 국내 판매한 경험이 있다. 다만 회사에 따르면 아직까지 확정된 사안은 없다.시장 관심은 마운자로가 위고비의 기세를 얼마나 꺾을 수 있을지에 쏠리고 있다. 위고비는 국내 정식 출시가 지연되는 와중에도, 일부 채널을 통해 유통되며 시장을 빠르게 잠식해 나갔다.시장조사기관 아이큐비아에 따르면 올해 1분기 위고비의 매출은 794억원을 기록했다. 전체 비만약 시장에서 위고비의 점유율은 73.2%에 달했다.세마글루타이드 성분 GLP-1 단일제인 위고비는 지난해 10월 국내 출시 직후부터 선풍적인 인기를 끌었다. 비싼 가격에도 높은 체중 감량 효과로 처방 수요가 급증했다. 위고비는 작년 4분기 매출 603억원을 올리며 단숨에 비만약 시장 선두에 올라섰다. 지난해 3분기 비만약 시장 규모는 474억원을 기록했는데 위고비 출시로 1분기 만에 938억원으로 97.9% 치솟았다.마운자로, 위고비보다 더 큰 체중감량 효과 입증한국릴리는 기존 치료제보다 더 큰 마운자로의 체중감량 효과에 기대를 걸고 있다. 마운자로는 인슐린 분비 자극 펩타이드(GIP) 수용체와 글루카곤 유사 펩타이드-1(GLP-1) 수용체에 모두 작용해 인슐린 분비 촉진, 인슐린 저항성 개선, 글루카곤 분비 감소 등으로 식전과 식후 혈당 감소를 유도한다.주요 당뇨병·비만 환자들은 인크레틴이 저하되는데 GLP-1 분비 감소와 GIP 인슐린 자극 효과의 장애가 주요 원인으로 꼽힌다. GLP-1과 GIP는 식후 인슐린 반응의 3분의 2를 책임지고 있는 호르몬이다.당뇨병, 비만치료제 '마운자로' 마운자로는 국내에서 성인 2형 당뇨병 환자의 혈당 조절 개선을 위한 식이요법과 운동요법의 보조제 및 성인 비만(초기 체질량지수(BMI)≥30kg/㎡) 환자, 또는 한 가지 체중 관련 동반질환(고혈압, 이상지질혈증, 제2형 당뇨병, 폐쇄성 수면 무호흡 또는 심혈관 질환)이 있는 과체중(초기 BMI 27kg/㎡ 이상, 30kg/㎡ 미만) 환자의 만성 체중 관리를 위한 저칼로리 식이요법 및 운동요법의 보조제로 허가됐다.마운자로는 혈당조절뿐 아니라 체중감량 효과가 뛰어나다는 장점이 있다. 마운자로는 주 1회 투여 만으로 당뇨병이 없고 BMI가 30kg/㎡ 이상이거나 동반질환이 하나 이상 있는 과체중 성인환자를 대상으로 진행한 SURMOUNT-1 임상3상 결과를 통해 체중 감소 효과를 입증했다.해당 임상에서 치료 72주째 마운자로 투여군은 평균 15% 이상의 체중 감소가 나타난 것으로 확인됐다. 가장 높은 용량을 투여한 군은 체중의 21%를 감량했다.특히 마운자로는 위고비와의 직접 비교 임상인 SURMOUNT-5에서도 체중 감량 효과의 우위를 나타냈다.임상 결과, 1차 평가변수에서 마운자로 투여군(10mg 또는 15mg)의 72주차 기준 평균 체중 감소율은 20.2%로, 위고비 투여군(1.7mg 또는 2.4mg)의 13.7%와 비교해 상대적으로 더 개선된 체중 감소율을 달성했다.릴리는 마운자로의 임상에서 체중 감량 효과를 확인한 만큼 동일 성분 비만치료제 젭바운드를 지난 2023년 11월 미국 시장에 출시한 바 있다. 국내에서는 당뇨병과 비만 적응증 모두 제품명 마운자로를 통해 유통된다.한국릴리는 마운자로의 2형 당뇨병 적응증을 통해 보험급여 신청에도 나서겠다는 계획이다.2025-08-08 06:00:00손형민 -
 중국 신약 급부상...글로벌 제약과 빅딜 연거푸 성사[데일리팜=손형민 기자] 글로벌 제약사가 올해 중국 제약바이오기업과의 대형 기술도입 계약을 잇달아 체결하며 차세대 신약 라인업 강화에 속도를 내고 있다. 항암·폐질환·대사질환 분야를 중심으로, 중국 이외의 지역 상업화 권리를 선점하는 전략이 두드러진다.GLP-1 타깃 비만·당뇨병 치료제 개발 활발7일 업계에 따르면 미국 마드리갈파마슈티컬스는 지난달 중국 CSPC로부터 경구용 GLP-1 수용체 작용제 후보물질 SYH2086의 글로벌 개발·상업화 권리를 확보했다. 이번 계약은 선급금 1억2000만 달러와 함께 개발·허가·상업화 단계별 최대 20억 달러(약 2조8000억원)의 마일스톤, 순매출 기준 로열티가 포함된 대형 계약이다. CSPC는 중국 내에서 다른 경구형 GLP-1 약물을 계속 개발·판매할 수 있는 권리를 유지한다.SYH2086은 오르포글립론(orforglipron) 계열의 소분자 GLP-1 수용체 작용제로, 대사이상 관련 지방간염(MASH) 치료에 중심을 둔 병용 전략의 핵심 축으로 개발될 예정이며 현재 전임상 단계로 내년 상반기 임상 착수를 목표하고 있다.마드리갈은 전 세계 최초로 MASH 신약 레즈디프라를 상업화 시킨 회사다. 이번 거래를 통해 마드리갈은 GLP-1과 MASH 신약 병용 가능성을 확인하겠다는 계획이다.현재 MASH 시장에서는 노보노디스크의 세마글루타이드가 올해 초 3상에서 긍정적 결과를 냈다. 이에 마드리갈은 레즈디프라와 GLP-1 병용요법이 MASH에서 더 큰 효과를 낼 것으로 기대하고 있다.마드리갈 최고메디컬책임자(CMO) 데이비드 서겔 박사는 “레즈디프라와 경구 GLP-1 병용요법의 개발 논리는 명확하다”며 “GLP-1을 통한 체중 감소 효과와 Rezdiffra의 섬유화·지질 감소 효과를 하루 한 번 복용하는 단일제에서 균형 있게 구현해, MASH에서 효능과 내약성을 최적화하는 것이 목표”라고 말했다.리제네론파마슈티컬스는 지난달 중국 항서제약과 GLP-1/GIP 수용체 작용제 HS-20094의 중국 외 개발·상업화 권리를 확보했다. 이번 계약은 선급금 8000만 달러와 함께 개발·허가·판매 마일스톤을 포함해 총 19억3000만 달러 규모에 달한다.HS-20094는 GLP-1과 GIP 두 호르몬 수용체를 동시에 활성화해 혈당 조절과 체중 감량 효과를 높이는 기전을 가진다. 이는 이미 릴리의 ‘젭바운드’로 입증된 타깃 전략과 유사하며 리제네론은 HS-20094가 “잠재적으로 유사한 프로파일”을 갖고 있다고 평가했다.항서제약은 중국 내에서 비만 환자 대상 임상3상, 당뇨 환자 대상 임상2b상을 진행 중이며, 지금까지 1000명 이상의 환자 데이터를 확보했다. 리제네론 최고과학책임자(CSO) 조지 얀코풀로스 박사는 “GLP-1/GIP 작용제 확보로 비만 분야 임상 프로그램의 범용성을 확대하고, 지속적이고 질 높은 체중 감량과 장기적인 건강 이점을 지원하는 우리의 목표를 가속화할 수 있다”고 말했다.리제네론은 현재 GDF8 항체 트레보그루맙(trevogrumab)을 포함한 비만 파이프라인을 보유하고 있으며, 위고비(세마글루타이드)와 병용 시 제지방 유지와 체지방 감소 동시 달성 가능성을 확인한 중간 임상2상 결과를 발표한 바 있다. 회사는 HS-20094와의 시너지 가능성에도 주목하고 있다.노보노디스크는 중국 유나이티드 래버러토리스(United Laboratories) 산하 유나이티드 바이오테크놀로지로부터 GLP-1/GIP/글루카곤 3중 작용제 UBT251의 중국 제외 글로벌 권리를 확보했다. 계약 규모는 선급금 2억 달러와 최대 18억 달러의 마일스톤을 포함해 총 20억 달러에 달하며, 단계별 로열티 지급 조건이 부가됐다.노보노디스크는 이번 거래를 통해 릴리의 3중 작용제 레타트루타이드의 경쟁 신약후보물질을 확보하는 데 성공했다.UBT251은 GLP-1과 GIP 수용체를 활성화하는 동시에 글루카곤 수용체까지 자극해 에너지 대사와 체중 감소를 극대화하는 기전을 가진다. 이미 릴리의 3중 작용제 ‘레타트루타이드’가 2023년 2상에서 24주 기준 16% 체중 감소를 입증한 바 있으며, UBT251은 이와 유사한 속도로 강력한 효과를 보여줄 잠재력을 지닌 것으로 평가된다.유나이티드가 실시한 임상1b상에 따르면, 비만 또는 과체중 환자 36명에게 6mg 피하주사를 투여했을 때 12주 만에 평균 15.1% 체중 감소가 관찰됐다. 이는 위고비가 68주 STEP-1 연구에서 기록한 14.9% 감소와 유사한 수준이다.마틴 홀스트 랑게 노보노디스크 개발 부문 부사장은 “글루카곤까지 포함한 3중 타깃 약물은 비만 및 심대사질환 치료 옵션의 다양성을 넓히고, 환자의 다양한 요구를 충족시키는 차별화된 포트폴리오 구축에 기여할 것”이라며 “UBT251의 잠재적 베스트인클래스 가능성을 심대사질환 전반에서 탐구하겠다”고 밝혔다.UBT251은 현재 중국에서 임상2b상이 진행 중이며, 노보노디스크는 초기 단계 R&D 조직 재편과 함께 차세대 비만 신약군의 핵심 축으로 개발을 이어갈 계획이다.다중항체 개발 가속화…GSK COPD 치료제 추가GSK는 지난달 중국 항서제약과 최대 12개 혁신신약을 공동 개발하는 대규모 협력 계약을 체결했다. 이번 계약은 선급금 5억 달러를 포함하며, 호흡기·면역·항암 분야에서 잠재력을 지닌 후보물질 확보가 목표다.계약의 핵심은 PDE3/4 이중억제제 HRS-9821의 독점 글로벌 라이선스(중국 본토·홍콩·마카오·대만 제외)다. 현재 만성폐쇄성폐질환(COPD) 유지요법으로 개발 중인 이 신약후보물질은 기존 흡입 스테로이드나 생물학적제제 투여 적합성이 낮은 환자군을 포함해 호흡곤란이 지속되는 환자층까지 치료 스펙트럼을 넓히는 전략에 맞춰진다.GSK는 이미 다수의 트렐리지, 아노로 등 다수 COPD 치료제를 보유하고 있다. 이번 계약을 통해 COPD 파이프라인 강화에 성공했다.HRS-9821은 PDE3·PDE4를 동시에 억제해 기관지 확장과 항염증 효과를 극대화하는 기전을 지닌다. 전임상과 초기 임상에서 강력한 효능을 보였으며, 건조분말흡입제(DPI) 제형 가능성을 갖춰 GSK의 기존 흡입제 포트폴리오와 전략적으로 맞물린다.이외에도 항서제약이 주도적으로 개발해 1상 완료 시점까지 진행할 추가 11개 프로그램이 포함됐다. 각 프로그램은 독립적인 재무 구조를 가지며, GSK는 1상 종료 후 또는 그 이전에 글로벌 권리 인수 여부를 선택할 수 있다. 계약에는 특정 프로그램 교체권도 포함됐다.GSK 측은 “이번 제휴로 2031년 이후 성장 동력을 확장할 수 있게 됐다”며 “HRS-9821과 추가 파이프라인은 호흡기·면역·종양 분야에서 환자 치료의 판도를 바꿀 잠재력이 있다”고 밝혔다.애브비는 지난 1월 열린 JP모건 헬스케어 2025에서 중국 심시어가 개발 중인 T세포 인게이저 후보물질 ‘SIM0500’에 10억 5000만 달러(약 1조5000억원)의 투자를 단행했다. SIM0500은 GPRC5D, BCMA, CD3 등을 표적하는 다중항체로, 이미 미국과 중국에서 다발성 골수종에 대한 임상 1상 연구가 진행되고 있다.애브비는 T세포 인게이저 치료제 개발에 속도를 내고 있다. 이 회사는 지난해 10월 T세포 인게이저 플랫폼을 보유한 미국 이볼브이뮨과 다중항체 개발권에 대한 파트너십 계약을 체결한 바 있다.T세포 인게이저는 암세포와 면역세포를 물리적으로 연결해 암을 치료하는 이중항체 기반의 모달리티다. 이 기전은 사람의 면역 시스템을 활용해 암을 공격하도록 유도할 수 있으며, 암세포를 더 정확하게 타깃하고 강력한 면역 반응을 일으킨다.다중항체는 2개의 다른 항원에 동시에 결합하거나, 동일한 항원에 있는 두 개의 서로 다른 항원결정부위에 동시에 결합할 수 있는 약물이다. 기존 CAR-T 치료제에 비해 즉시 투여가 가능하며, 제조 과정이 간소화돼 환자 접근성이 높다고 알려진다.이에 많은 글로벌제약사들도 T세포 인게이저 플랫폼을 통해 다중항체 개발에 나서고 있다.화이자는 지난달 중국 3SBio로부터 PD-1×VEGF 이중항체 SSGJ-707의 중국 제외 글로벌 권리를 확보했다. 계약 규모는 선급금 12억5,000만 달러와 최대 48억 달러의 개발·허가·판매 마일스톤, 1억 달러의 지분 투자, 승인 시 두 자릿수 로열티 지급 조건을 포함한다.SSGJ-707은 면역관문 억제(PD-1)와 혈관신생 억제(VEGF) 기전을 동시에 겨냥해 종양 미세환경에서 면역 억제와 종양 혈관 형성을 동시에 차단하는 구조다. 3SBio는 2023년부터 비소세포폐암, 대장암, 난소암 등을 대상으로 4건의 2상 임상을 중국에서 진행해 왔다.올해 시작 예정인 1차 PD-L1 양성 비소세포폐암 3상 진입 전, SSGJ-707은 2상 데이터에서 1차 비소세포폐암 환자군의 객관적반응률(ORR)은 70.8%였으며, 항암화학요법 병용 시 최대 81.3%에 달했다. 3차 대장암 환자군에서는 ORR 33.3%를 기록해 경쟁 약물이 성과를 내지 못한 영역에서 가능성을 보여줬다.2025-08-07 12:00:00손형민
중국 신약 급부상...글로벌 제약과 빅딜 연거푸 성사[데일리팜=손형민 기자] 글로벌 제약사가 올해 중국 제약바이오기업과의 대형 기술도입 계약을 잇달아 체결하며 차세대 신약 라인업 강화에 속도를 내고 있다. 항암·폐질환·대사질환 분야를 중심으로, 중국 이외의 지역 상업화 권리를 선점하는 전략이 두드러진다.GLP-1 타깃 비만·당뇨병 치료제 개발 활발7일 업계에 따르면 미국 마드리갈파마슈티컬스는 지난달 중국 CSPC로부터 경구용 GLP-1 수용체 작용제 후보물질 SYH2086의 글로벌 개발·상업화 권리를 확보했다. 이번 계약은 선급금 1억2000만 달러와 함께 개발·허가·상업화 단계별 최대 20억 달러(약 2조8000억원)의 마일스톤, 순매출 기준 로열티가 포함된 대형 계약이다. CSPC는 중국 내에서 다른 경구형 GLP-1 약물을 계속 개발·판매할 수 있는 권리를 유지한다.SYH2086은 오르포글립론(orforglipron) 계열의 소분자 GLP-1 수용체 작용제로, 대사이상 관련 지방간염(MASH) 치료에 중심을 둔 병용 전략의 핵심 축으로 개발될 예정이며 현재 전임상 단계로 내년 상반기 임상 착수를 목표하고 있다.마드리갈은 전 세계 최초로 MASH 신약 레즈디프라를 상업화 시킨 회사다. 이번 거래를 통해 마드리갈은 GLP-1과 MASH 신약 병용 가능성을 확인하겠다는 계획이다.현재 MASH 시장에서는 노보노디스크의 세마글루타이드가 올해 초 3상에서 긍정적 결과를 냈다. 이에 마드리갈은 레즈디프라와 GLP-1 병용요법이 MASH에서 더 큰 효과를 낼 것으로 기대하고 있다.마드리갈 최고메디컬책임자(CMO) 데이비드 서겔 박사는 “레즈디프라와 경구 GLP-1 병용요법의 개발 논리는 명확하다”며 “GLP-1을 통한 체중 감소 효과와 Rezdiffra의 섬유화·지질 감소 효과를 하루 한 번 복용하는 단일제에서 균형 있게 구현해, MASH에서 효능과 내약성을 최적화하는 것이 목표”라고 말했다.리제네론파마슈티컬스는 지난달 중국 항서제약과 GLP-1/GIP 수용체 작용제 HS-20094의 중국 외 개발·상업화 권리를 확보했다. 이번 계약은 선급금 8000만 달러와 함께 개발·허가·판매 마일스톤을 포함해 총 19억3000만 달러 규모에 달한다.HS-20094는 GLP-1과 GIP 두 호르몬 수용체를 동시에 활성화해 혈당 조절과 체중 감량 효과를 높이는 기전을 가진다. 이는 이미 릴리의 ‘젭바운드’로 입증된 타깃 전략과 유사하며 리제네론은 HS-20094가 “잠재적으로 유사한 프로파일”을 갖고 있다고 평가했다.항서제약은 중국 내에서 비만 환자 대상 임상3상, 당뇨 환자 대상 임상2b상을 진행 중이며, 지금까지 1000명 이상의 환자 데이터를 확보했다. 리제네론 최고과학책임자(CSO) 조지 얀코풀로스 박사는 “GLP-1/GIP 작용제 확보로 비만 분야 임상 프로그램의 범용성을 확대하고, 지속적이고 질 높은 체중 감량과 장기적인 건강 이점을 지원하는 우리의 목표를 가속화할 수 있다”고 말했다.리제네론은 현재 GDF8 항체 트레보그루맙(trevogrumab)을 포함한 비만 파이프라인을 보유하고 있으며, 위고비(세마글루타이드)와 병용 시 제지방 유지와 체지방 감소 동시 달성 가능성을 확인한 중간 임상2상 결과를 발표한 바 있다. 회사는 HS-20094와의 시너지 가능성에도 주목하고 있다.노보노디스크는 중국 유나이티드 래버러토리스(United Laboratories) 산하 유나이티드 바이오테크놀로지로부터 GLP-1/GIP/글루카곤 3중 작용제 UBT251의 중국 제외 글로벌 권리를 확보했다. 계약 규모는 선급금 2억 달러와 최대 18억 달러의 마일스톤을 포함해 총 20억 달러에 달하며, 단계별 로열티 지급 조건이 부가됐다.노보노디스크는 이번 거래를 통해 릴리의 3중 작용제 레타트루타이드의 경쟁 신약후보물질을 확보하는 데 성공했다.UBT251은 GLP-1과 GIP 수용체를 활성화하는 동시에 글루카곤 수용체까지 자극해 에너지 대사와 체중 감소를 극대화하는 기전을 가진다. 이미 릴리의 3중 작용제 ‘레타트루타이드’가 2023년 2상에서 24주 기준 16% 체중 감소를 입증한 바 있으며, UBT251은 이와 유사한 속도로 강력한 효과를 보여줄 잠재력을 지닌 것으로 평가된다.유나이티드가 실시한 임상1b상에 따르면, 비만 또는 과체중 환자 36명에게 6mg 피하주사를 투여했을 때 12주 만에 평균 15.1% 체중 감소가 관찰됐다. 이는 위고비가 68주 STEP-1 연구에서 기록한 14.9% 감소와 유사한 수준이다.마틴 홀스트 랑게 노보노디스크 개발 부문 부사장은 “글루카곤까지 포함한 3중 타깃 약물은 비만 및 심대사질환 치료 옵션의 다양성을 넓히고, 환자의 다양한 요구를 충족시키는 차별화된 포트폴리오 구축에 기여할 것”이라며 “UBT251의 잠재적 베스트인클래스 가능성을 심대사질환 전반에서 탐구하겠다”고 밝혔다.UBT251은 현재 중국에서 임상2b상이 진행 중이며, 노보노디스크는 초기 단계 R&D 조직 재편과 함께 차세대 비만 신약군의 핵심 축으로 개발을 이어갈 계획이다.다중항체 개발 가속화…GSK COPD 치료제 추가GSK는 지난달 중국 항서제약과 최대 12개 혁신신약을 공동 개발하는 대규모 협력 계약을 체결했다. 이번 계약은 선급금 5억 달러를 포함하며, 호흡기·면역·항암 분야에서 잠재력을 지닌 후보물질 확보가 목표다.계약의 핵심은 PDE3/4 이중억제제 HRS-9821의 독점 글로벌 라이선스(중국 본토·홍콩·마카오·대만 제외)다. 현재 만성폐쇄성폐질환(COPD) 유지요법으로 개발 중인 이 신약후보물질은 기존 흡입 스테로이드나 생물학적제제 투여 적합성이 낮은 환자군을 포함해 호흡곤란이 지속되는 환자층까지 치료 스펙트럼을 넓히는 전략에 맞춰진다.GSK는 이미 다수의 트렐리지, 아노로 등 다수 COPD 치료제를 보유하고 있다. 이번 계약을 통해 COPD 파이프라인 강화에 성공했다.HRS-9821은 PDE3·PDE4를 동시에 억제해 기관지 확장과 항염증 효과를 극대화하는 기전을 지닌다. 전임상과 초기 임상에서 강력한 효능을 보였으며, 건조분말흡입제(DPI) 제형 가능성을 갖춰 GSK의 기존 흡입제 포트폴리오와 전략적으로 맞물린다.이외에도 항서제약이 주도적으로 개발해 1상 완료 시점까지 진행할 추가 11개 프로그램이 포함됐다. 각 프로그램은 독립적인 재무 구조를 가지며, GSK는 1상 종료 후 또는 그 이전에 글로벌 권리 인수 여부를 선택할 수 있다. 계약에는 특정 프로그램 교체권도 포함됐다.GSK 측은 “이번 제휴로 2031년 이후 성장 동력을 확장할 수 있게 됐다”며 “HRS-9821과 추가 파이프라인은 호흡기·면역·종양 분야에서 환자 치료의 판도를 바꿀 잠재력이 있다”고 밝혔다.애브비는 지난 1월 열린 JP모건 헬스케어 2025에서 중국 심시어가 개발 중인 T세포 인게이저 후보물질 ‘SIM0500’에 10억 5000만 달러(약 1조5000억원)의 투자를 단행했다. SIM0500은 GPRC5D, BCMA, CD3 등을 표적하는 다중항체로, 이미 미국과 중국에서 다발성 골수종에 대한 임상 1상 연구가 진행되고 있다.애브비는 T세포 인게이저 치료제 개발에 속도를 내고 있다. 이 회사는 지난해 10월 T세포 인게이저 플랫폼을 보유한 미국 이볼브이뮨과 다중항체 개발권에 대한 파트너십 계약을 체결한 바 있다.T세포 인게이저는 암세포와 면역세포를 물리적으로 연결해 암을 치료하는 이중항체 기반의 모달리티다. 이 기전은 사람의 면역 시스템을 활용해 암을 공격하도록 유도할 수 있으며, 암세포를 더 정확하게 타깃하고 강력한 면역 반응을 일으킨다.다중항체는 2개의 다른 항원에 동시에 결합하거나, 동일한 항원에 있는 두 개의 서로 다른 항원결정부위에 동시에 결합할 수 있는 약물이다. 기존 CAR-T 치료제에 비해 즉시 투여가 가능하며, 제조 과정이 간소화돼 환자 접근성이 높다고 알려진다.이에 많은 글로벌제약사들도 T세포 인게이저 플랫폼을 통해 다중항체 개발에 나서고 있다.화이자는 지난달 중국 3SBio로부터 PD-1×VEGF 이중항체 SSGJ-707의 중국 제외 글로벌 권리를 확보했다. 계약 규모는 선급금 12억5,000만 달러와 최대 48억 달러의 개발·허가·판매 마일스톤, 1억 달러의 지분 투자, 승인 시 두 자릿수 로열티 지급 조건을 포함한다.SSGJ-707은 면역관문 억제(PD-1)와 혈관신생 억제(VEGF) 기전을 동시에 겨냥해 종양 미세환경에서 면역 억제와 종양 혈관 형성을 동시에 차단하는 구조다. 3SBio는 2023년부터 비소세포폐암, 대장암, 난소암 등을 대상으로 4건의 2상 임상을 중국에서 진행해 왔다.올해 시작 예정인 1차 PD-L1 양성 비소세포폐암 3상 진입 전, SSGJ-707은 2상 데이터에서 1차 비소세포폐암 환자군의 객관적반응률(ORR)은 70.8%였으며, 항암화학요법 병용 시 최대 81.3%에 달했다. 3차 대장암 환자군에서는 ORR 33.3%를 기록해 경쟁 약물이 성과를 내지 못한 영역에서 가능성을 보여줬다.2025-08-07 12:00:00손형민 -
 팍스로비드·코미나티 글로벌 매출 3년 새 95% '뚝'[데일리팜=손형민 기자] 지난 2분기 화이자의 글로벌 코로나 의약품 매출이 반등했다. 다만 글로벌 팬데믹이 한창이던 지난 2022년 2분기와 비교하면 감소세가 뚜렷한 모습이다. 당시 23조원(169억6300만 달러)에 달하던 코로나 백신 '코미나티'와 치료제 '팍스로비드'의 합산 매출은 올해 2분기 1조원(8억800만 달러) 규모로 쪼그라들었다.상당수 국가에서 접종 권고 대상을 축소하거나 고위험군을 중심으로 치료 전략을 전환하고 있어, 향후 코로나 백신·치료제의 수요는 더욱 감소할 것으로 전망된다. 화이자는 이러한 리스크에 대비해 재고·공급 조절과 병용치료제 포트폴리오 확대 전략을 병행하고 있다.코미나티·팍스로비드 글로벌 매출 반등…장기적으론 감소세 뚜렷7일 화이자 글로벌 실적 자료에 따르면 이 회사는 지난 2분기 146억5300만 달러(약 20조원)의 매출을 기록했다. 작년 2분기와 비교하면 1년 새 10% 증가했다.코로나 백신 코미나티와 치료제 팍스로비드의 실적 반등이 전체 매출 확대에 일부 기여했다. 2분기 코미나티의 글로벌 매출은 3억8100만 달러(약 5300억원)로 전년 동기 대비 95% 증가했다. 화이자는 미국 시장에서의 점유율 확대와 일부 국가로의 공급 증가를 매출 증가의 배경으로 설명했다.팍스로비드는 전년 동기 대비 70% 증가한 4억2700만 달러(약 6000억원)를 기록했다. 화이자는 미국 정부와의 구매 계약 종료로 민간 시장 전환 이후 평균 약가가 상승한 효과라고 설명했다. 또한 과거 기간에 대한 리베이트 정산 조정이 반영되면서 팍스로비드의 매출이 증가했다고 덧붙였다.다만 글로벌 팬데믹이 절정이던 2022년과 비교하면 장기적으로는 감소세가 확연하다.화이자는 지난 2021~2022년 코미나티와 팍스로비드를 통해 사상 최대 실적을 올렸다. 코미나티의 경우 2021년 368억 달러, 2022년에는 378억 달러(약 52조원)의 매출을 기록했다. 당시 휴미라를 누르고 전 세계 의약품 매출 순위 1위를 기록하기도 했다.그러나 엔데믹과 함께 매출이 급감했다. 코미나티의 2023년 매출은 112억 달러(약 16조원)로 전년 대비 71% 감소했다. 2024년엔 50억1900만 달러로 더욱 감소했다. 이후론 매 분기마다 들쭉날쭉한 매출이 이어지고 있다. 팍스로비드도 마찬가지 상황이다. 출시 초기 공급난에 시달릴 정도로 수요가 크게 올랐다. 2022년에만 378억5600만 달러(약 53조원)의 매출을 기록했다. 그러나 엔데믹과 함께 투여 대상군이 급감하며 매출은 감소세에 접어들었다. 팍스로비드는 2023년 12억7900만 달러, 2024년 57억1600만 달러의 매출을 각각 기록하는 데 그쳤다.화이자의 전체 매출에서 코미나티와 팍스로비드가 차지하는 비중도 크게 줄었다. 2022년엔 두 제품이 화이자 전체 매출의 57%를 차지했다. 그러나 올해 2분기엔 두 제품의 매출 비중이 6% 수준으로 쪼그라들었다.'LP.8.1 변이' 대응 백신 개발 속도…병용치료제 포트폴리오 확대 계획화이자 코로나19 백신 '코미나티'화이자는 팬데믹 이후 수요 감소에 대응해 변이 맞춤형 백신 개발을 이어가고 있다. 회사 측은 오미크론 계열 하위변이인 LP.8.1에 대응하는 단가 백신을 새롭게 출시할 계획이다.지난달 화이자와 바이오엔텍은 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 LP.8.1 변이에 대응하는 코미나티의 판매승인 권고를 받은 이후 유럽연합 집행위원회(EC)로부터 정식 승인을 획득했다. 이 백신은 생후 6개월 이상을 대상으로 접종이 가능하다.미국에서도 이와 관련한 절차가 진행 중이다. 화이자는 지난 6월 미국 식품의약국(FDA)에 LP.8.1 변이에 대응하는 코미나티에 대한 승인 신청서를 제출하고, 올가을 접종 시즌에 맞춘 공급 준비에 착수했다.화이자는 “코로나19는 여전히 주요한 공중보건 이슈로, 특히 고위험군을 중심으로 백신 수요가 지속되고 있다”며 “새로운 변이에 신속히 대응할 수 있는 백신 포트폴리오를 유지해 나갈 것”이라고 밝혔다.화이자 코로나19 치료제 '팍스로비드'팍스로비드의 경우 코로나 재유행 양상에 따라 매출 변동폭이 커질 것이란 전망이다. 업계에선 예년처럼 가을 이후 코로나와 독감 등이 동시 유행할 경우 팍스로비드 처방실적이 다시 증가할 수 있다는 전망이 나온다.화이자는 “코로나19는 여전히 주요 공중보건 이슈다. 적응형 백신, 병용 치료제 등으로 포트폴리오를 유지할 것”이라며 “감염 패턴 변화, 접종 권고 범위, 환자 순응도 등에 따라 수요는 유동적일 수 있다”고 덧붙였다.2025-08-07 06:00:00손형민
팍스로비드·코미나티 글로벌 매출 3년 새 95% '뚝'[데일리팜=손형민 기자] 지난 2분기 화이자의 글로벌 코로나 의약품 매출이 반등했다. 다만 글로벌 팬데믹이 한창이던 지난 2022년 2분기와 비교하면 감소세가 뚜렷한 모습이다. 당시 23조원(169억6300만 달러)에 달하던 코로나 백신 '코미나티'와 치료제 '팍스로비드'의 합산 매출은 올해 2분기 1조원(8억800만 달러) 규모로 쪼그라들었다.상당수 국가에서 접종 권고 대상을 축소하거나 고위험군을 중심으로 치료 전략을 전환하고 있어, 향후 코로나 백신·치료제의 수요는 더욱 감소할 것으로 전망된다. 화이자는 이러한 리스크에 대비해 재고·공급 조절과 병용치료제 포트폴리오 확대 전략을 병행하고 있다.코미나티·팍스로비드 글로벌 매출 반등…장기적으론 감소세 뚜렷7일 화이자 글로벌 실적 자료에 따르면 이 회사는 지난 2분기 146억5300만 달러(약 20조원)의 매출을 기록했다. 작년 2분기와 비교하면 1년 새 10% 증가했다.코로나 백신 코미나티와 치료제 팍스로비드의 실적 반등이 전체 매출 확대에 일부 기여했다. 2분기 코미나티의 글로벌 매출은 3억8100만 달러(약 5300억원)로 전년 동기 대비 95% 증가했다. 화이자는 미국 시장에서의 점유율 확대와 일부 국가로의 공급 증가를 매출 증가의 배경으로 설명했다.팍스로비드는 전년 동기 대비 70% 증가한 4억2700만 달러(약 6000억원)를 기록했다. 화이자는 미국 정부와의 구매 계약 종료로 민간 시장 전환 이후 평균 약가가 상승한 효과라고 설명했다. 또한 과거 기간에 대한 리베이트 정산 조정이 반영되면서 팍스로비드의 매출이 증가했다고 덧붙였다.다만 글로벌 팬데믹이 절정이던 2022년과 비교하면 장기적으로는 감소세가 확연하다.화이자는 지난 2021~2022년 코미나티와 팍스로비드를 통해 사상 최대 실적을 올렸다. 코미나티의 경우 2021년 368억 달러, 2022년에는 378억 달러(약 52조원)의 매출을 기록했다. 당시 휴미라를 누르고 전 세계 의약품 매출 순위 1위를 기록하기도 했다.그러나 엔데믹과 함께 매출이 급감했다. 코미나티의 2023년 매출은 112억 달러(약 16조원)로 전년 대비 71% 감소했다. 2024년엔 50억1900만 달러로 더욱 감소했다. 이후론 매 분기마다 들쭉날쭉한 매출이 이어지고 있다. 팍스로비드도 마찬가지 상황이다. 출시 초기 공급난에 시달릴 정도로 수요가 크게 올랐다. 2022년에만 378억5600만 달러(약 53조원)의 매출을 기록했다. 그러나 엔데믹과 함께 투여 대상군이 급감하며 매출은 감소세에 접어들었다. 팍스로비드는 2023년 12억7900만 달러, 2024년 57억1600만 달러의 매출을 각각 기록하는 데 그쳤다.화이자의 전체 매출에서 코미나티와 팍스로비드가 차지하는 비중도 크게 줄었다. 2022년엔 두 제품이 화이자 전체 매출의 57%를 차지했다. 그러나 올해 2분기엔 두 제품의 매출 비중이 6% 수준으로 쪼그라들었다.'LP.8.1 변이' 대응 백신 개발 속도…병용치료제 포트폴리오 확대 계획화이자 코로나19 백신 '코미나티'화이자는 팬데믹 이후 수요 감소에 대응해 변이 맞춤형 백신 개발을 이어가고 있다. 회사 측은 오미크론 계열 하위변이인 LP.8.1에 대응하는 단가 백신을 새롭게 출시할 계획이다.지난달 화이자와 바이오엔텍은 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 LP.8.1 변이에 대응하는 코미나티의 판매승인 권고를 받은 이후 유럽연합 집행위원회(EC)로부터 정식 승인을 획득했다. 이 백신은 생후 6개월 이상을 대상으로 접종이 가능하다.미국에서도 이와 관련한 절차가 진행 중이다. 화이자는 지난 6월 미국 식품의약국(FDA)에 LP.8.1 변이에 대응하는 코미나티에 대한 승인 신청서를 제출하고, 올가을 접종 시즌에 맞춘 공급 준비에 착수했다.화이자는 “코로나19는 여전히 주요한 공중보건 이슈로, 특히 고위험군을 중심으로 백신 수요가 지속되고 있다”며 “새로운 변이에 신속히 대응할 수 있는 백신 포트폴리오를 유지해 나갈 것”이라고 밝혔다.화이자 코로나19 치료제 '팍스로비드'팍스로비드의 경우 코로나 재유행 양상에 따라 매출 변동폭이 커질 것이란 전망이다. 업계에선 예년처럼 가을 이후 코로나와 독감 등이 동시 유행할 경우 팍스로비드 처방실적이 다시 증가할 수 있다는 전망이 나온다.화이자는 “코로나19는 여전히 주요 공중보건 이슈다. 적응형 백신, 병용 치료제 등으로 포트폴리오를 유지할 것”이라며 “감염 패턴 변화, 접종 권고 범위, 환자 순응도 등에 따라 수요는 유동적일 수 있다”고 덧붙였다.2025-08-07 06:00:00손형민 -
 대웅 파트너사 에볼루스, 2분기 매출 4%↑…나보타 830억원[데일리팜=손형민 기자] 대웅제약의 파트너사 에볼루스의 2분기 매출이 전년동기 대비 4% 증가했다.보툴리눔톡신 제제 나보타(미국 제품명 주보)가 선전하고 필러 신제품이 가세한 결과로 풀이된다. 다만 미국 내 미용시술 수요 감소의 여파로 기존의 성장세는 다소 둔화한 것으로 나타났다.에볼루스 성장세 이어가…나보타 830억·필러 신제품 130억원 합작6일 에볼루스 실적 자료에 따르면 이 회사의 올해 2분기 매출은 6940만 달러(약 960억원)로 전년 동기 대비 4% 증가했다. 상반기 매출은 1억3790만 달러(약 1900억원)로, 전년대비 9% 늘었다.나보타가 매출 상승을 견인했다. 나보타의 2분기 매출은 5970만 달러(약 830억원)로, 에볼루스 전체 매출의 86%를 차지한다. 에볼루스가 나보타의 매출을 별도 공개한 건 이번이 처음이다.대웅제약은 에볼루스와 지난 2013년 2억9680만 달러(약 3750억원) 규모로 나보타 공급 계약을 맺은 바 있다. 가장 먼저 나보타가 허가된 곳은 북미 시장이다. 나보타는 2018년 캐나다에 허가된 이후 미국에서 2019년 2월 승인됐다. 이후 에볼루스는 여러 유럽 국가에 공급 지역을 확대했다.에볼루스는 현재 미국·캐나다 외에도 유럽·호주·일본 등에서 나보타를 판매하고 있다. 올해 상반기까지 누적 고객 계정 수는 1만6500개 이상이다. 재구매율은 약 70%를 유지 중이다. 에볼루스는 나보타 출시 이후 급성장을 반복했다. 2020년 5650만 달러였던 에볼루스 매출은 이듬해 9970만 달러를 기록하며 76% 늘었다.2022년엔 1억4860만 달러를 기록하며 처음으로 1억 달러 이상 매출을 기록했고, 2023년엔 2억 달러를 돌파했다. 이어 지난해엔 매출 2억6630만 달러를 기록했다. 회사가 작년 초 목표로 제시했던 2억6500만 달러를 초과 달성했다. 특히 작년 4분기엔 7900만 달러의 매출을 기록하며 분기 기준 최고 기록을 세웠다.다만 올해 1·2분기엔 각 6900만 달러의 매출을 올리며 성장세가 다소 둔화된 흐름이다. 에볼루스는 미국 시장 내 소비심리 위축으로 일부 의료기관의 주문량이 감소했지만, 시장 점유율 14%를 유지하며 방어에 성공했다고 설명했다.에볼루스는 제품 다변화로 성장세를 이어간다는 방침이다. 지난 4월 출시한 필러 신제품 '에볼리제'가 시장 안착에 성공했다는 평가다. 에볼리제는 출시 첫 분기인 지난 2분기 970만 달러(약 134억원)의 매출을 올렸다. 에볼리제는 히알루론산(HA) 주사제로, 4가지 제품에 대해 의료기기 인증(MDR)을 받았다.에볼루스는 2분기 성장세 둔화로 인해 올해 전체 매출 전망을 하향 조정했다. 에볼루스는 기존 최대 3억5500만 달러를 달성할 것으로 내다봤지만, 2분기 실적 발표와 함께 3억500만달러로 연 매출 목표치를 낮췄다. 다만 2028년까지 매출 7억 달러, 영업이익률 20% 달성 목표는 그대로 유지한다는 방침이다.에볼루스는 “2분기 미국 시장 위축으로 매출에 영향을 받았지만 하반기에는 필러 제품군 확대, 신규 고객 확보, 글로벌 매출 확대에 힘입어 성장세를 회복할 것”이라며 “2028년까지 멀티 포트폴리오 뷰티 기업으로의 전환을 완성하겠다”고 말했다.2025-08-06 12:00:00손형민
대웅 파트너사 에볼루스, 2분기 매출 4%↑…나보타 830억원[데일리팜=손형민 기자] 대웅제약의 파트너사 에볼루스의 2분기 매출이 전년동기 대비 4% 증가했다.보툴리눔톡신 제제 나보타(미국 제품명 주보)가 선전하고 필러 신제품이 가세한 결과로 풀이된다. 다만 미국 내 미용시술 수요 감소의 여파로 기존의 성장세는 다소 둔화한 것으로 나타났다.에볼루스 성장세 이어가…나보타 830억·필러 신제품 130억원 합작6일 에볼루스 실적 자료에 따르면 이 회사의 올해 2분기 매출은 6940만 달러(약 960억원)로 전년 동기 대비 4% 증가했다. 상반기 매출은 1억3790만 달러(약 1900억원)로, 전년대비 9% 늘었다.나보타가 매출 상승을 견인했다. 나보타의 2분기 매출은 5970만 달러(약 830억원)로, 에볼루스 전체 매출의 86%를 차지한다. 에볼루스가 나보타의 매출을 별도 공개한 건 이번이 처음이다.대웅제약은 에볼루스와 지난 2013년 2억9680만 달러(약 3750억원) 규모로 나보타 공급 계약을 맺은 바 있다. 가장 먼저 나보타가 허가된 곳은 북미 시장이다. 나보타는 2018년 캐나다에 허가된 이후 미국에서 2019년 2월 승인됐다. 이후 에볼루스는 여러 유럽 국가에 공급 지역을 확대했다.에볼루스는 현재 미국·캐나다 외에도 유럽·호주·일본 등에서 나보타를 판매하고 있다. 올해 상반기까지 누적 고객 계정 수는 1만6500개 이상이다. 재구매율은 약 70%를 유지 중이다. 에볼루스는 나보타 출시 이후 급성장을 반복했다. 2020년 5650만 달러였던 에볼루스 매출은 이듬해 9970만 달러를 기록하며 76% 늘었다.2022년엔 1억4860만 달러를 기록하며 처음으로 1억 달러 이상 매출을 기록했고, 2023년엔 2억 달러를 돌파했다. 이어 지난해엔 매출 2억6630만 달러를 기록했다. 회사가 작년 초 목표로 제시했던 2억6500만 달러를 초과 달성했다. 특히 작년 4분기엔 7900만 달러의 매출을 기록하며 분기 기준 최고 기록을 세웠다.다만 올해 1·2분기엔 각 6900만 달러의 매출을 올리며 성장세가 다소 둔화된 흐름이다. 에볼루스는 미국 시장 내 소비심리 위축으로 일부 의료기관의 주문량이 감소했지만, 시장 점유율 14%를 유지하며 방어에 성공했다고 설명했다.에볼루스는 제품 다변화로 성장세를 이어간다는 방침이다. 지난 4월 출시한 필러 신제품 '에볼리제'가 시장 안착에 성공했다는 평가다. 에볼리제는 출시 첫 분기인 지난 2분기 970만 달러(약 134억원)의 매출을 올렸다. 에볼리제는 히알루론산(HA) 주사제로, 4가지 제품에 대해 의료기기 인증(MDR)을 받았다.에볼루스는 2분기 성장세 둔화로 인해 올해 전체 매출 전망을 하향 조정했다. 에볼루스는 기존 최대 3억5500만 달러를 달성할 것으로 내다봤지만, 2분기 실적 발표와 함께 3억500만달러로 연 매출 목표치를 낮췄다. 다만 2028년까지 매출 7억 달러, 영업이익률 20% 달성 목표는 그대로 유지한다는 방침이다.에볼루스는 “2분기 미국 시장 위축으로 매출에 영향을 받았지만 하반기에는 필러 제품군 확대, 신규 고객 확보, 글로벌 매출 확대에 힘입어 성장세를 회복할 것”이라며 “2028년까지 멀티 포트폴리오 뷰티 기업으로의 전환을 완성하겠다”고 말했다.2025-08-06 12:00:00손형민 -
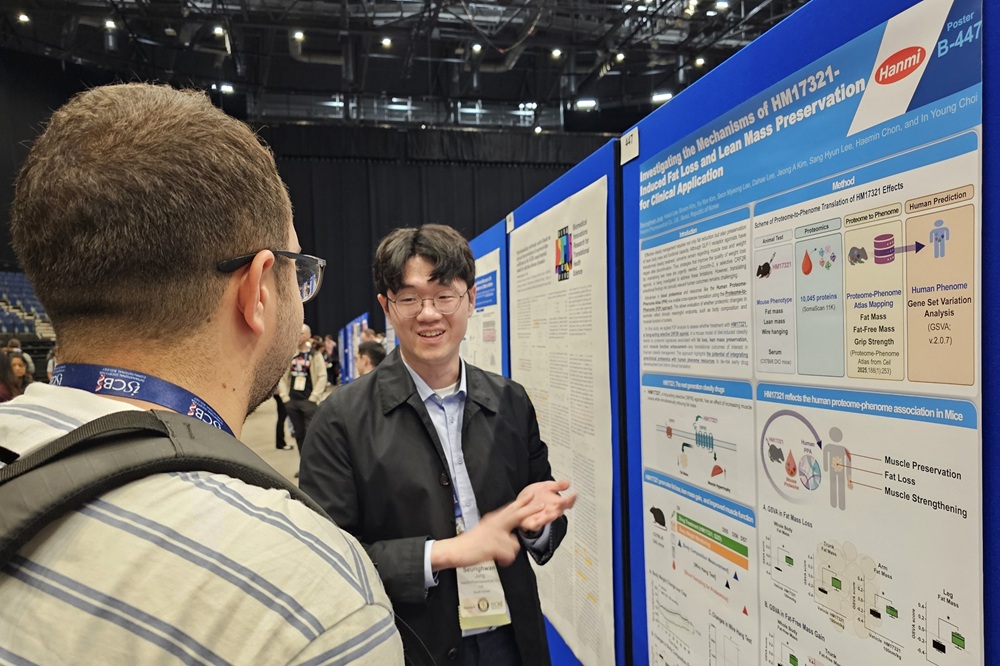 한미약품 "근육 증가 비만신약, 임상 진입 청신호"한미약품 R&D센터 정승환 선임연구원이 지난 7월 22일(현지시각) 영국 리버풀에서 열린 ‘ISMB/ECCB 2025’에서 신개념 비만치료제 HM17321의 주요 연구 내용이 담긴 포스터를 토대로 참석자에게 설명하고 있다. [데일리팜=손형민 기자] 한미약품은 지난달 20일부터 24일까지(현지시각) 영국 리버풀에서 열린 ‘ISMB(Intelligent Systems for Molecular Biology) / ECCB(European Conference on Computational Biology) 2025’에 참가해 HM17321의 근육량 증가와 근기능 강화 등 대사 건강을 증진시키면서 비만 개선 효과를 확인한 비임상 연구 결과를 포스터로 발표했다고 5일 밝혔다.이번 ISMB/ECCB 학회에서 한미약품은 동물 단백질 오믹스 데이터와 인간 유래 바이오 빅데이터를 통합 분석해, 동물 실험에서 입증한 HM17321의 효능이 인체에서도 재현될 가능성을 예측한 머신러닝 기반 분석 결과를 공개했다.HM17321은 GLP-1을 비롯한 인크레틴 수용체가 아닌 CRF2(corticotropin-releasing factor 2) 수용체를 선택적으로 타깃하는 UCN 2(Urocortin 2) 유사체로, 한미약품 R&D센터에 내재화된 최첨단 인공지능 및 구조 모델링 기술을 활용해 설계됐다.특히 이 신약은 단순히 근손실을 보완하는 수준을 넘어 기존에 불가능하다고 여겨졌던 ‘근육량 증가’와 ‘지방 선택적 감량’을 동시에 구현하는 비만 혁신 신약으로 개발되고 있다.이번에 발표한 연구에서는 HM17321이 투약된 동물 혈액에서의 단백체와, 다양한 질병 또는 신체적 특성을 가진 사람 혈액의 단백체를 비교했다. 그 결과, HM17321은 ‘지방량이 적고 제지방량이 많으며 악력이 높은 사람’의 단백체 특성과 유사한 변화를 유도하는 것으로 나타났다.연구 결과는 HM17321의 동물 실험 효능을 재확인함과 동시에, 해당 효능이 인체에서도 실현될 가능성을 시사한다. 또 단일 동물 실험으로는 확인하기 어려운 추가 효능, 적응증, 잠재적 부작용 등을 폭넓게 탐색할 수 있어, 향후 비임상 및 임상 개발 전략을 정교화하고 R&D 효율성을 제고하는 데 활용할 수 있을 것으로 기대된다.전해민 R&D센터 임상이행팀장(상무)은 “전임상에서 임상으로 넘어가는 과정은 전체 신약개발 과정에서 가장 큰 불확실성을 지니고 있는 단계”라며 “이번 연구는 이러한 불확실성을 상당 부분 해소할 수 있는 유용한 도구를 제공하고, 한미의 신약개발 효율화에 크게 기여할 것으로 기대한다”고 말했다.한미약품 R&D센터 임상이행팀은 동물 및 사람에서 확보한 유전체와 전사체, 단백질체 등 다중 오믹스 자료와 바이오 빅데이터를 기반으로, 최신 생물정보학 기법과 머신러닝 기술을 접목한 다양한 접근을 통해 자체 개발한 신약 후보물질의 임상 반응 및 부작용을 사전에 예측하는 연구를 진행하고 있다.최인영 R&D센터장(전무)은 “임상 1상 진입을 앞둔 HM17321의 약리 효과가 인체에서도 재현될 가능성을 과학적으로 입증한 의미 있는 성과”라며 “단순 체중 감량을 넘어, 근육 기능과 대사 건강까지 아우르는 ‘질적인 감량’이라는 새로운 패러다임을 제시하며, ‘글로벌 비만 치료의 표준’을 만들어 나가겠다”고 말했다.2025-08-05 11:21:13손형민
한미약품 "근육 증가 비만신약, 임상 진입 청신호"한미약품 R&D센터 정승환 선임연구원이 지난 7월 22일(현지시각) 영국 리버풀에서 열린 ‘ISMB/ECCB 2025’에서 신개념 비만치료제 HM17321의 주요 연구 내용이 담긴 포스터를 토대로 참석자에게 설명하고 있다. [데일리팜=손형민 기자] 한미약품은 지난달 20일부터 24일까지(현지시각) 영국 리버풀에서 열린 ‘ISMB(Intelligent Systems for Molecular Biology) / ECCB(European Conference on Computational Biology) 2025’에 참가해 HM17321의 근육량 증가와 근기능 강화 등 대사 건강을 증진시키면서 비만 개선 효과를 확인한 비임상 연구 결과를 포스터로 발표했다고 5일 밝혔다.이번 ISMB/ECCB 학회에서 한미약품은 동물 단백질 오믹스 데이터와 인간 유래 바이오 빅데이터를 통합 분석해, 동물 실험에서 입증한 HM17321의 효능이 인체에서도 재현될 가능성을 예측한 머신러닝 기반 분석 결과를 공개했다.HM17321은 GLP-1을 비롯한 인크레틴 수용체가 아닌 CRF2(corticotropin-releasing factor 2) 수용체를 선택적으로 타깃하는 UCN 2(Urocortin 2) 유사체로, 한미약품 R&D센터에 내재화된 최첨단 인공지능 및 구조 모델링 기술을 활용해 설계됐다.특히 이 신약은 단순히 근손실을 보완하는 수준을 넘어 기존에 불가능하다고 여겨졌던 ‘근육량 증가’와 ‘지방 선택적 감량’을 동시에 구현하는 비만 혁신 신약으로 개발되고 있다.이번에 발표한 연구에서는 HM17321이 투약된 동물 혈액에서의 단백체와, 다양한 질병 또는 신체적 특성을 가진 사람 혈액의 단백체를 비교했다. 그 결과, HM17321은 ‘지방량이 적고 제지방량이 많으며 악력이 높은 사람’의 단백체 특성과 유사한 변화를 유도하는 것으로 나타났다.연구 결과는 HM17321의 동물 실험 효능을 재확인함과 동시에, 해당 효능이 인체에서도 실현될 가능성을 시사한다. 또 단일 동물 실험으로는 확인하기 어려운 추가 효능, 적응증, 잠재적 부작용 등을 폭넓게 탐색할 수 있어, 향후 비임상 및 임상 개발 전략을 정교화하고 R&D 효율성을 제고하는 데 활용할 수 있을 것으로 기대된다.전해민 R&D센터 임상이행팀장(상무)은 “전임상에서 임상으로 넘어가는 과정은 전체 신약개발 과정에서 가장 큰 불확실성을 지니고 있는 단계”라며 “이번 연구는 이러한 불확실성을 상당 부분 해소할 수 있는 유용한 도구를 제공하고, 한미의 신약개발 효율화에 크게 기여할 것으로 기대한다”고 말했다.한미약품 R&D센터 임상이행팀은 동물 및 사람에서 확보한 유전체와 전사체, 단백질체 등 다중 오믹스 자료와 바이오 빅데이터를 기반으로, 최신 생물정보학 기법과 머신러닝 기술을 접목한 다양한 접근을 통해 자체 개발한 신약 후보물질의 임상 반응 및 부작용을 사전에 예측하는 연구를 진행하고 있다.최인영 R&D센터장(전무)은 “임상 1상 진입을 앞둔 HM17321의 약리 효과가 인체에서도 재현될 가능성을 과학적으로 입증한 의미 있는 성과”라며 “단순 체중 감량을 넘어, 근육 기능과 대사 건강까지 아우르는 ‘질적인 감량’이라는 새로운 패러다임을 제시하며, ‘글로벌 비만 치료의 표준’을 만들어 나가겠다”고 말했다.2025-08-05 11:21:13손형민 -
 지오영 "폭염·장마 대비 의약품 보관체계 강화"지오영 천안물류센터 전경. [데일리팜=손형민 기자] 의약품 유통기업 지오영(대표이사 조선혜 회장)은 올여름 연이은 폭염과 장마로 인한 기상 악화 속에서도 안정적인 물류 역량을 유지하기 위해, 전국 55개 물류센터의 의약품 보관 시스템을 상향 대응하고 있다고 5일 밝혔다.지오영은 고온다습한 환경에서도 의약품을 안정적인 조건에서 관리하기 위해, 각 물류 거점에 구축된 항온·항습·공조 설비를 최대한으로 가동하며 외부 환경 변화에 능동적으로 대응하고 있다.특히 생물학적제제처럼 온도와 습도 변화에 민감한 품목의 특성을 고려해 자동 제어 시스템으로 항시 균일한 보관 환경을 유지하고 있으며, 일부 센터에는 제습기와 냉방 장치를 보완해 더욱 세밀한 환경 조절이 가능하도록 했다.또 보관 단계뿐 아니라 배송 과정에서도 품질 변화가 발생하지 않도록 철저한 관리를 이어가고 있다. 지오영은 콜드체인 설비를 갖춘 냉장 차량과 함께, 의약품 전용 폼박스 및 냉매를 활용해 최종 배송 단계까지 품질이 안정적으로 유지되도록 하고 있다.지오영은 기상 변화로 인한 의약품 손상과 보관 상태 저하를 사전에 막기 위한 다각적인 예방 조치도 함께 진행 중이다. 지오영 천안센터, 스마트허브센터, 신강남센터 등 최근 신설·확장된 대형 거점 물류센터들은 상하차 작업 전 과정을 실내에서 수행할 수 있도록 설계돼, 폭우 시에도 의약품이 외부 환경에 노출되지 않도록 차단하고 있는 게 지오영의 설명이다.지오영에 따르면 상하차 공간이 외부에 위치한 일부 기존 센터의 경우에는 차량 위에 천막을 설치하거나 박스를 비닐로 감싸는 방식으로 기후 노출을 최소화하고 있으며, 파레트 래핑 보강이나 작업 시간 조정 등을 통해 지역별 기상 여건에 탄력적으로 대응하고 있다.아울러 지오영은 물류 단계 전반의 품질 관리는 물론, 현장 배송 반장들의 안전까지 최우선으로 고려하고 있다. 각 물류센터에서는 출차 전 기상 상황에 따라 운행 경로를 점검하고, 침수 우려 지역이나 미끄럼 사고 위험 구간 등의 변동 정보를 수시로 공유하며 안전 운행을 당부하고 있다. 폭우 등으로 배송 지연이 불가피할 경우에는 약국 등 고객에게 사전 개별 안내를 통해 불편을 최소화하기 위해 노력하고 있다.지오영 조선혜 회장은 “의약품 유통은 국민 건강과 직결되는 사회 보건의료 인프라의 핵심”이라며 “폭염과 장마 같은 기상 악조건 속에서도 지오영의 물류시스템과 현장 구성원들의 축적된 노하우를 바탕으로, 의약품이 적시에 안정적으로 보관·유통될 수 있도록 최선을 다하겠다”고 밝혔다.2025-08-05 10:00:40손형민
지오영 "폭염·장마 대비 의약품 보관체계 강화"지오영 천안물류센터 전경. [데일리팜=손형민 기자] 의약품 유통기업 지오영(대표이사 조선혜 회장)은 올여름 연이은 폭염과 장마로 인한 기상 악화 속에서도 안정적인 물류 역량을 유지하기 위해, 전국 55개 물류센터의 의약품 보관 시스템을 상향 대응하고 있다고 5일 밝혔다.지오영은 고온다습한 환경에서도 의약품을 안정적인 조건에서 관리하기 위해, 각 물류 거점에 구축된 항온·항습·공조 설비를 최대한으로 가동하며 외부 환경 변화에 능동적으로 대응하고 있다.특히 생물학적제제처럼 온도와 습도 변화에 민감한 품목의 특성을 고려해 자동 제어 시스템으로 항시 균일한 보관 환경을 유지하고 있으며, 일부 센터에는 제습기와 냉방 장치를 보완해 더욱 세밀한 환경 조절이 가능하도록 했다.또 보관 단계뿐 아니라 배송 과정에서도 품질 변화가 발생하지 않도록 철저한 관리를 이어가고 있다. 지오영은 콜드체인 설비를 갖춘 냉장 차량과 함께, 의약품 전용 폼박스 및 냉매를 활용해 최종 배송 단계까지 품질이 안정적으로 유지되도록 하고 있다.지오영은 기상 변화로 인한 의약품 손상과 보관 상태 저하를 사전에 막기 위한 다각적인 예방 조치도 함께 진행 중이다. 지오영 천안센터, 스마트허브센터, 신강남센터 등 최근 신설·확장된 대형 거점 물류센터들은 상하차 작업 전 과정을 실내에서 수행할 수 있도록 설계돼, 폭우 시에도 의약품이 외부 환경에 노출되지 않도록 차단하고 있는 게 지오영의 설명이다.지오영에 따르면 상하차 공간이 외부에 위치한 일부 기존 센터의 경우에는 차량 위에 천막을 설치하거나 박스를 비닐로 감싸는 방식으로 기후 노출을 최소화하고 있으며, 파레트 래핑 보강이나 작업 시간 조정 등을 통해 지역별 기상 여건에 탄력적으로 대응하고 있다.아울러 지오영은 물류 단계 전반의 품질 관리는 물론, 현장 배송 반장들의 안전까지 최우선으로 고려하고 있다. 각 물류센터에서는 출차 전 기상 상황에 따라 운행 경로를 점검하고, 침수 우려 지역이나 미끄럼 사고 위험 구간 등의 변동 정보를 수시로 공유하며 안전 운행을 당부하고 있다. 폭우 등으로 배송 지연이 불가피할 경우에는 약국 등 고객에게 사전 개별 안내를 통해 불편을 최소화하기 위해 노력하고 있다.지오영 조선혜 회장은 “의약품 유통은 국민 건강과 직결되는 사회 보건의료 인프라의 핵심”이라며 “폭염과 장마 같은 기상 악조건 속에서도 지오영의 물류시스템과 현장 구성원들의 축적된 노하우를 바탕으로, 의약품이 적시에 안정적으로 보관·유통될 수 있도록 최선을 다하겠다”고 밝혔다.2025-08-05 10:00:40손형민 -
 디스크 신약 두번째 실패…엔솔바이오, R&D 다각화 주력[데일리팜=손형민 기자] 엔솔바이오사이언스가 개발한 퇴행성 디스크 치료제 후보물질이 미국 임상 3상에서 1차 평가변수 달성에 실패했다. 유한양행이 과거 임상2b상에서 위약 대비 유효성을 입증하지 못한 데 이어, 이번 실패로 글로벌 상용화에 다시 한 번 제동이 걸렸다. 회사 측은 위약군 반응률 급등이 주요 원인이라며, 파트너사와의 협력과 함께 골관절염·알츠하이머·항암제 등 다른 파이프라인 개발 속도를 높이겠다는 방침이다.5일 관련 업계에 따르면 미국 스파인바이오파마가 최근 공개한 임상 3상 탑라인 결과에서 디스크병 치료제 후보물질 ‘SB-01’은 1차 평가변수를 충족하지 못했다.SB-01은 합성 7아미노산 펩타이드로, 변성된 추간판(Intervertebral disc)에서 과발현되는 전환성장인자베타1(TGFβ1)에 결합해 발현을 낮추는 기전을 갖고 있다. TGFβ1의 비정상 신호전달은 추간판 구조를 유지하는 세포외기질 성분의 분해와 관련이 있으며, 신경성장인자(NGF) 발현을 촉진해 감각신경 수를 늘리고 디스크성 통증을 유발하는 것으로 알려져 있다.스파인바이오파마는 SB-01을 추간판 내 직접 주사해 통증·기능장애를 개선하고, 디스크 변성 진행을 억제하는 ‘혁신신약(First-in-Class)’후보물질로 개발해 왔다.임상 결과, 6개월 시점 NRS(통증 척도)·ODI(기능 장애 지수) 복합 지표에서 SB-01 투여군은 위약 대비 개선을 보였으나 p값은 0.051로 통계적 유의성 기준에 미달한 것으로 나타났다. SB-01군의 복합 성공률은 67%로 임상적으로 의미 있는 수준이었지만, 위약군 반응률이 높게 나타난 것이 발목을 잡았다.이처럼 스파인바이오파마는 위약군 반응률 급등이 임상 실패의 주요 원인이라고 설명했다. 스파인바이오파마 측은 일부 임상 기관에서 예상치를 웃도는 위약 효과가 관찰됐다고 밝혔다.하위 분석에서 정상 수준의 위약 반응률을 보인 기관의 환자 227명만 따로 분석하면, SB-01군의 성공률은 70%로 위약군 59%를 상회했고(p값: 0.051), ODI 단독 지표에서도 SB-01군 79% 위약군 69%(p값: 0.040)로 통계적 유의성을 확보했다.엔솔바이오는 “국내 임상2상에서도 생리식염수 투여만으로 높은 통증 완화 효과가 나왔던 만큼, 위약 효과 배제가 통증 치료제 개발의 핵심 과제임을 인식해 왔다”며 “Sham 대조군(효과없는 가짜 의료기기) 설계 등 위약 통제 전략을 강화했음에도 불구하고 이번에 장기간 통증 개선이 나타난 것은 예측하기 어려운 결과였다”고 말했다.이어 “스파인바이오파마는 다양한 전략과 옵션을 검토하며 SB-01 개발을 계속 추진하겠다는 의지를 밝혀왔다”며 “FDA와 NDA(신약허가신청) 경로 협의와 추가 임상 병행을 통해 글로벌 상용화를 목표로 협력하겠다”고 덧붙였다.SB-01의 임상 실패는 이번이 두번째다. 엔솔바이오는 지난 2009년 유한양행에 SB-01(유한양행 후보물질명: YH14618)을 기술이전한 후 공동 개발을 시작했다.당초 유한양행은 임상1, 2a상을 통해 SB-01의 효능과 안정성을 입증했지만 2016년 10월 완료된 임상 2b상 결과 위약 대비 통계적 유의성을 입증하지 못하면서 개발 중단 결정을 내렸다.유한양행은 임상중단 직후 추가 사업화에 매진한 결과 2018년 7월 스파인바이오파마와 총 2억1815만달러 규모의 기술수출 계약을 성사시켰다. 계약금은 65만달러, 개발·허가 및 매출에 따른 단계별 마일스톤은 2억1750만달러다.스파인바이오파마는 미국 식품의약국(FDA)으로부터 임상 2상 생략을 허용하는 임상개시승인(SMP, Study May Procced)을 받아 2022년 6월 첫 환자 투여를 시작으로 임상 3상을 진행해왔다. 다만 유한양행이 진행했던 임상2상과 마찬가지로 SB-01의 유효성은 위약군 대비 통계적으로 유의하지 않았다.유한양행은 지난 2011년 45억원을 투자해 엔솔바이오 주식 101만860주(지분율 11.4%)를 확보하며 2대주주에 올랐다. 이후 유한양행은 2021년 엔솔바이오 투자 10년 만에 주식 20만주(지분율 3.99%)를 시간외매매로 30억원에 처분했다.유한양행은 지난 6월 엔솔바이오 지분 취득 이후 14년 만에 주식 전량을 처분했다. 유한양행의 엔솔바이오 주식 처분금액은 총 172억원이다. 투자금을 제외하고 127억원의 수익을 확보했다.골관절염·알츠하이머·항암제 시장 등 다양한 영역 진출 모색엔솔바이오는 TGF-β 기전을 바탕으로 다수의 후속 파이프라인에 개발 속도를 내겠다는 계획이다.현재 엔솔바이오는 국내에서 활성대조군 비교를 적용한 골관절염 치료제 ‘E1K(엔게디1000)’의 임상 3상 진입을 준비 중이다. E1K는 TGF-β1 신호전달 경로를 선택적으로 조절해 연골 퇴행을 억제하고 재생을 유도하는 합성 펩타이드로, 임상 2상에서 통증 완화와 관절 기능 개선을 입증했다.엔솔바이오 항암, 중추신경계 신약 파이프라인 현황(자료= 엔솔바이오). 알츠하이머 치료제 ‘M1K(모리아1000)’는 β-아밀로이드의 뇌 유입을 차단하고 뇌 염증과 신경세포 사멸을 억제하는 기전을 보유하고 있다. 경도인지장애 단계 환자를 대상으로 한 근원적 치료제 개발을 목표로, 전임상 단계에서 학습·기억 회복 효과를 확인했다.엔솔바이오는 항암제 파이프라인도 확장 중이다. ‘C1K’와 ‘C2K’는 TGF-β/Smad2 경로를 조절해 면역항암제 내성을 극복하고 종양세포 사멸을 촉진하는 항암제다. SMAD2는 TGF에 의해 활성화되는 세포 내 신호 전달, 전사 조절 인자다. 세포 신호 전달 경로 연구에 사용되는 항체의 표적이 될 수 있다.C1K는 삼중음성유방암 모델에서 PD-1 항체·파클리탁셀과의 병용 시 종양 성장 억제와 전이 감소를 입증했으며, 건강인 대상 임상 1a에서 안전성을 확보했다.C2K의 경우 비소세포폐암 후보물질로 개발 중이다. 전임상에서 C2K는 마우스 비소세포폐암 세포주 LLC 이식동물모델에서 단독 투여에 의한 종양 성장 억제 효과를 확인했다. 회사는 C2K와 면역항암제 병용 효과를 기대하고 있다.또 TROP2 표적 고리형 펩타이드 ‘D1K’는 PDC(펩타이드-약물 접합체) 개발의 핵심 모듈로, 유방암·폐암 등 다양한 암종을 타깃으로 임상 연구가 진행 중이다.TROP2 단백질은 삼중음성유방암(TNBC)을 포함한 다양한 암종에서 과발현되며, 다트로웨이는 해당 단백질에 결합한 뒤 세포독성 약물을 암세포 내에 전달해 사멸을 유도한다. 기존 세포독성 항암제의 효과를 유지하면서도 정상 세포 손상을 줄이는 것이 특징이다.또 비만·대사질환 치료제 ‘H1K(하닷사1000)’는 체중 감량과 간 지방 감소를 동시에 겨냥하며, 글로벌 제약사와의 사업개발(BD) 논의도 병행 중이다.엔솔바이오는 “SB-01 임상 결과는 아쉽지만, 이번 분석을 통해 기전의 타당성과 안전성을 다시 확인했다”며 “E1K, M1K, C1K 등 후발 파이프라인에서 가시적 성과가 도출되면 코스닥 이전 상장도 추진할 계획”이라고 밝혔다.2025-08-05 06:17:00손형민
디스크 신약 두번째 실패…엔솔바이오, R&D 다각화 주력[데일리팜=손형민 기자] 엔솔바이오사이언스가 개발한 퇴행성 디스크 치료제 후보물질이 미국 임상 3상에서 1차 평가변수 달성에 실패했다. 유한양행이 과거 임상2b상에서 위약 대비 유효성을 입증하지 못한 데 이어, 이번 실패로 글로벌 상용화에 다시 한 번 제동이 걸렸다. 회사 측은 위약군 반응률 급등이 주요 원인이라며, 파트너사와의 협력과 함께 골관절염·알츠하이머·항암제 등 다른 파이프라인 개발 속도를 높이겠다는 방침이다.5일 관련 업계에 따르면 미국 스파인바이오파마가 최근 공개한 임상 3상 탑라인 결과에서 디스크병 치료제 후보물질 ‘SB-01’은 1차 평가변수를 충족하지 못했다.SB-01은 합성 7아미노산 펩타이드로, 변성된 추간판(Intervertebral disc)에서 과발현되는 전환성장인자베타1(TGFβ1)에 결합해 발현을 낮추는 기전을 갖고 있다. TGFβ1의 비정상 신호전달은 추간판 구조를 유지하는 세포외기질 성분의 분해와 관련이 있으며, 신경성장인자(NGF) 발현을 촉진해 감각신경 수를 늘리고 디스크성 통증을 유발하는 것으로 알려져 있다.스파인바이오파마는 SB-01을 추간판 내 직접 주사해 통증·기능장애를 개선하고, 디스크 변성 진행을 억제하는 ‘혁신신약(First-in-Class)’후보물질로 개발해 왔다.임상 결과, 6개월 시점 NRS(통증 척도)·ODI(기능 장애 지수) 복합 지표에서 SB-01 투여군은 위약 대비 개선을 보였으나 p값은 0.051로 통계적 유의성 기준에 미달한 것으로 나타났다. SB-01군의 복합 성공률은 67%로 임상적으로 의미 있는 수준이었지만, 위약군 반응률이 높게 나타난 것이 발목을 잡았다.이처럼 스파인바이오파마는 위약군 반응률 급등이 임상 실패의 주요 원인이라고 설명했다. 스파인바이오파마 측은 일부 임상 기관에서 예상치를 웃도는 위약 효과가 관찰됐다고 밝혔다.하위 분석에서 정상 수준의 위약 반응률을 보인 기관의 환자 227명만 따로 분석하면, SB-01군의 성공률은 70%로 위약군 59%를 상회했고(p값: 0.051), ODI 단독 지표에서도 SB-01군 79% 위약군 69%(p값: 0.040)로 통계적 유의성을 확보했다.엔솔바이오는 “국내 임상2상에서도 생리식염수 투여만으로 높은 통증 완화 효과가 나왔던 만큼, 위약 효과 배제가 통증 치료제 개발의 핵심 과제임을 인식해 왔다”며 “Sham 대조군(효과없는 가짜 의료기기) 설계 등 위약 통제 전략을 강화했음에도 불구하고 이번에 장기간 통증 개선이 나타난 것은 예측하기 어려운 결과였다”고 말했다.이어 “스파인바이오파마는 다양한 전략과 옵션을 검토하며 SB-01 개발을 계속 추진하겠다는 의지를 밝혀왔다”며 “FDA와 NDA(신약허가신청) 경로 협의와 추가 임상 병행을 통해 글로벌 상용화를 목표로 협력하겠다”고 덧붙였다.SB-01의 임상 실패는 이번이 두번째다. 엔솔바이오는 지난 2009년 유한양행에 SB-01(유한양행 후보물질명: YH14618)을 기술이전한 후 공동 개발을 시작했다.당초 유한양행은 임상1, 2a상을 통해 SB-01의 효능과 안정성을 입증했지만 2016년 10월 완료된 임상 2b상 결과 위약 대비 통계적 유의성을 입증하지 못하면서 개발 중단 결정을 내렸다.유한양행은 임상중단 직후 추가 사업화에 매진한 결과 2018년 7월 스파인바이오파마와 총 2억1815만달러 규모의 기술수출 계약을 성사시켰다. 계약금은 65만달러, 개발·허가 및 매출에 따른 단계별 마일스톤은 2억1750만달러다.스파인바이오파마는 미국 식품의약국(FDA)으로부터 임상 2상 생략을 허용하는 임상개시승인(SMP, Study May Procced)을 받아 2022년 6월 첫 환자 투여를 시작으로 임상 3상을 진행해왔다. 다만 유한양행이 진행했던 임상2상과 마찬가지로 SB-01의 유효성은 위약군 대비 통계적으로 유의하지 않았다.유한양행은 지난 2011년 45억원을 투자해 엔솔바이오 주식 101만860주(지분율 11.4%)를 확보하며 2대주주에 올랐다. 이후 유한양행은 2021년 엔솔바이오 투자 10년 만에 주식 20만주(지분율 3.99%)를 시간외매매로 30억원에 처분했다.유한양행은 지난 6월 엔솔바이오 지분 취득 이후 14년 만에 주식 전량을 처분했다. 유한양행의 엔솔바이오 주식 처분금액은 총 172억원이다. 투자금을 제외하고 127억원의 수익을 확보했다.골관절염·알츠하이머·항암제 시장 등 다양한 영역 진출 모색엔솔바이오는 TGF-β 기전을 바탕으로 다수의 후속 파이프라인에 개발 속도를 내겠다는 계획이다.현재 엔솔바이오는 국내에서 활성대조군 비교를 적용한 골관절염 치료제 ‘E1K(엔게디1000)’의 임상 3상 진입을 준비 중이다. E1K는 TGF-β1 신호전달 경로를 선택적으로 조절해 연골 퇴행을 억제하고 재생을 유도하는 합성 펩타이드로, 임상 2상에서 통증 완화와 관절 기능 개선을 입증했다.엔솔바이오 항암, 중추신경계 신약 파이프라인 현황(자료= 엔솔바이오). 알츠하이머 치료제 ‘M1K(모리아1000)’는 β-아밀로이드의 뇌 유입을 차단하고 뇌 염증과 신경세포 사멸을 억제하는 기전을 보유하고 있다. 경도인지장애 단계 환자를 대상으로 한 근원적 치료제 개발을 목표로, 전임상 단계에서 학습·기억 회복 효과를 확인했다.엔솔바이오는 항암제 파이프라인도 확장 중이다. ‘C1K’와 ‘C2K’는 TGF-β/Smad2 경로를 조절해 면역항암제 내성을 극복하고 종양세포 사멸을 촉진하는 항암제다. SMAD2는 TGF에 의해 활성화되는 세포 내 신호 전달, 전사 조절 인자다. 세포 신호 전달 경로 연구에 사용되는 항체의 표적이 될 수 있다.C1K는 삼중음성유방암 모델에서 PD-1 항체·파클리탁셀과의 병용 시 종양 성장 억제와 전이 감소를 입증했으며, 건강인 대상 임상 1a에서 안전성을 확보했다.C2K의 경우 비소세포폐암 후보물질로 개발 중이다. 전임상에서 C2K는 마우스 비소세포폐암 세포주 LLC 이식동물모델에서 단독 투여에 의한 종양 성장 억제 효과를 확인했다. 회사는 C2K와 면역항암제 병용 효과를 기대하고 있다.또 TROP2 표적 고리형 펩타이드 ‘D1K’는 PDC(펩타이드-약물 접합체) 개발의 핵심 모듈로, 유방암·폐암 등 다양한 암종을 타깃으로 임상 연구가 진행 중이다.TROP2 단백질은 삼중음성유방암(TNBC)을 포함한 다양한 암종에서 과발현되며, 다트로웨이는 해당 단백질에 결합한 뒤 세포독성 약물을 암세포 내에 전달해 사멸을 유도한다. 기존 세포독성 항암제의 효과를 유지하면서도 정상 세포 손상을 줄이는 것이 특징이다.또 비만·대사질환 치료제 ‘H1K(하닷사1000)’는 체중 감량과 간 지방 감소를 동시에 겨냥하며, 글로벌 제약사와의 사업개발(BD) 논의도 병행 중이다.엔솔바이오는 “SB-01 임상 결과는 아쉽지만, 이번 분석을 통해 기전의 타당성과 안전성을 다시 확인했다”며 “E1K, M1K, C1K 등 후발 파이프라인에서 가시적 성과가 도출되면 코스닥 이전 상장도 추진할 계획”이라고 밝혔다.2025-08-05 06:17:00손형민 -
 '듀피젠트' 상반기 매출 12조원...'최다 적응증'에 날개[데일리팜=손형민 기자] 사노피와 리제네론이 공동 개발한 생물학적제제 듀피젠트가 올해도 성장세를 이어가며 면역질환 시장에서 입지를 더욱 강화하고 있다. 듀피젠트의 상반기 매출은 10조원 이상을 기록했다. 듀피젠트는 아토피, 천식에 이어 호산구성식도염 만성폐쇄성폐질환(COPD), 등 새로운 적응증을 추가하며 매출 고공행진을 이어가고 있다. 사노피는 다수 후기 임상을 통해 듀피젠트의 적응증 추가를 지속하겠다는 계획이다.4일 사노피 실적 자료에 따르면 듀피젠트의 올해 2분기 글로벌 매출은 38억3200만 유로(약 6조61700억원)로 전년 동기 33억300만 유로 대비 15.6% 증가했다. 올해 상반기 누적 매출은 73억1200만 유로(약 11조8000억원)로 집계돼, 지난해 상반기 61억3800만 유로보다 19.1% 늘었다.듀피젠트의 올해 상반기 매출과 2022년 동기 35억7700만 유로를 비교해보면 3년새 2배 이상 증가한 것으로 확인됐다. 듀피젠트는 2형 염증의 주요 원인 물질인 인터루킨(IL)-4, IL-13의 신호 전달을 표적하는 최초의 생물학적제제다.사노피와 리제네론의 글로벌 협업 계약에 따라 공동개발된 듀피젠트는 국내를 비롯해 미국, 캐나다, 유럽, 일본, 호주 등 여러 국가에서 아토피 치료제로 시판 허가를 받았다. 2018년 글로벌 시장에 본격 출시된 듀피젠트는 효과와 안전성을 무기로 시장을 잠식해 나가고 있다.듀피젠트는 2018년 1분기 1억700만 유로를 올린 이후 2022년 1분기에 처음으로 분기 매출 10억 유로(약 1조5000억원) 이상을 기록했다. 듀피젠트는 2022년 4분기에 분기 매출 20억 유로 이상을 기록했으며, 지난해 3분기에는 30억 유로를 돌파했다.연도별로 살펴봐도 듀피젠트의 성장세는 더욱 두드러진다. 2022년 듀피젠트의 한해 매출은 77억8200만 유로(약 12조5000억원)에 머물렀지만, 이듬해 107억1500만 유로를 기록하며 37.7% 올랐다. 지난해 매출은 131억1400만 유로(약 21조원)로 2023년보다 23.1% 늘어났다.임상 다수 진행…적응증 추가 노력 지속사노피·리제네론 '듀피젠트'인터루킨을 타깃하는 생물학적제제가 다수 등장했지만, 듀피젠트의 입지는 공고하다. 이 치료제는 IL-4와 13에 작용하는 다양한 염증성 질환 적응증을 추가하며 치료 범위를 넓히고 있기 때문이다.듀피젠트는 2017년 미국 식품의약국(FDA)으로부터 아토피피부염 적응증을 허가 받은 데 이어 이듬해 중등증 이상 천식 환자에 승인되며 처방 범위가 넓어졌다. 현재 미국에서 모든 연령을 대상으로 한 천식 치료제는 듀피젠트가 유일하다.듀피젠트는 현재까지 아토피피부염, 천식, 부비동염, 호산구성식도염, COPD, 결절성 발진 등 주요 면역·호흡기 질환에서 시판 허가를 확보했다. 인터루킨을 타깃하는 생물학적제제 중 가장 많은 적응증을 보유 중이다.사노피는 이에 만족하지 않고 기존 질환에서의 시장 점유율을 넓히는 동시에, 의학적 미충족 수요가 큰 희귀·난치 질환 영역으로 적응증을 확장 중이다.사노피가 이번 2분기에 공개한 연구개발(R&D) 현황에 따르면 현재 진행 중인 후기임상은 총 8건이다.성인 수포성천포창 환자를 대상으로 한 임상 3상연구 ‘LIBERTY-BP’을 비롯해, 노바티스의 생물학적제제 졸레어(오말리주맙)에 불응하거나 미경험인 만성 자발 두드러기(CSU) 환자 대상 3상 연구 ‘LIBERTY-CSU CUPID’과 2~12세 소아 환자 대상 3상 ‘LIBERTY-CSU CUPIDKids’가 포함된다.이와 함께 호산구성 위염과 십이지장염 환자를 대상으로 한 2/3상 연구 ‘ENGAGE’, 원인불명 만성 소양증(CPUO) 성인 대상 3상 ‘LIBERTY-CPUO-CHIC’, 만성 단순 태선 환자를 대상으로 한 임상3상 ‘STYLE 1, 2’도 진행 중이다.또 사노피는 호산구성 표현형을 가진 중등증~중증 궤양성 대장염 환자를 대상으로 한 임상2상(LIBERTY-UC SUCCEED)도 진행하면서 피부·호흡기 질환을 넘어 위장관·알레르기 질환 등 다양한 영역으로 임상 범위를 넓히고 있다.사노피는 “8건의 적응증 확대 임상을 통해 듀피젠트를 장기 성장동력으로 육성하겠다”며 “미충족 수요가 높은 질환에서 새로운 치료 옵션을 제시하는 것이 목표”라고 밝혔다.2025-08-04 12:00:28손형민
'듀피젠트' 상반기 매출 12조원...'최다 적응증'에 날개[데일리팜=손형민 기자] 사노피와 리제네론이 공동 개발한 생물학적제제 듀피젠트가 올해도 성장세를 이어가며 면역질환 시장에서 입지를 더욱 강화하고 있다. 듀피젠트의 상반기 매출은 10조원 이상을 기록했다. 듀피젠트는 아토피, 천식에 이어 호산구성식도염 만성폐쇄성폐질환(COPD), 등 새로운 적응증을 추가하며 매출 고공행진을 이어가고 있다. 사노피는 다수 후기 임상을 통해 듀피젠트의 적응증 추가를 지속하겠다는 계획이다.4일 사노피 실적 자료에 따르면 듀피젠트의 올해 2분기 글로벌 매출은 38억3200만 유로(약 6조61700억원)로 전년 동기 33억300만 유로 대비 15.6% 증가했다. 올해 상반기 누적 매출은 73억1200만 유로(약 11조8000억원)로 집계돼, 지난해 상반기 61억3800만 유로보다 19.1% 늘었다.듀피젠트의 올해 상반기 매출과 2022년 동기 35억7700만 유로를 비교해보면 3년새 2배 이상 증가한 것으로 확인됐다. 듀피젠트는 2형 염증의 주요 원인 물질인 인터루킨(IL)-4, IL-13의 신호 전달을 표적하는 최초의 생물학적제제다.사노피와 리제네론의 글로벌 협업 계약에 따라 공동개발된 듀피젠트는 국내를 비롯해 미국, 캐나다, 유럽, 일본, 호주 등 여러 국가에서 아토피 치료제로 시판 허가를 받았다. 2018년 글로벌 시장에 본격 출시된 듀피젠트는 효과와 안전성을 무기로 시장을 잠식해 나가고 있다.듀피젠트는 2018년 1분기 1억700만 유로를 올린 이후 2022년 1분기에 처음으로 분기 매출 10억 유로(약 1조5000억원) 이상을 기록했다. 듀피젠트는 2022년 4분기에 분기 매출 20억 유로 이상을 기록했으며, 지난해 3분기에는 30억 유로를 돌파했다.연도별로 살펴봐도 듀피젠트의 성장세는 더욱 두드러진다. 2022년 듀피젠트의 한해 매출은 77억8200만 유로(약 12조5000억원)에 머물렀지만, 이듬해 107억1500만 유로를 기록하며 37.7% 올랐다. 지난해 매출은 131억1400만 유로(약 21조원)로 2023년보다 23.1% 늘어났다.임상 다수 진행…적응증 추가 노력 지속사노피·리제네론 '듀피젠트'인터루킨을 타깃하는 생물학적제제가 다수 등장했지만, 듀피젠트의 입지는 공고하다. 이 치료제는 IL-4와 13에 작용하는 다양한 염증성 질환 적응증을 추가하며 치료 범위를 넓히고 있기 때문이다.듀피젠트는 2017년 미국 식품의약국(FDA)으로부터 아토피피부염 적응증을 허가 받은 데 이어 이듬해 중등증 이상 천식 환자에 승인되며 처방 범위가 넓어졌다. 현재 미국에서 모든 연령을 대상으로 한 천식 치료제는 듀피젠트가 유일하다.듀피젠트는 현재까지 아토피피부염, 천식, 부비동염, 호산구성식도염, COPD, 결절성 발진 등 주요 면역·호흡기 질환에서 시판 허가를 확보했다. 인터루킨을 타깃하는 생물학적제제 중 가장 많은 적응증을 보유 중이다.사노피는 이에 만족하지 않고 기존 질환에서의 시장 점유율을 넓히는 동시에, 의학적 미충족 수요가 큰 희귀·난치 질환 영역으로 적응증을 확장 중이다.사노피가 이번 2분기에 공개한 연구개발(R&D) 현황에 따르면 현재 진행 중인 후기임상은 총 8건이다.성인 수포성천포창 환자를 대상으로 한 임상 3상연구 ‘LIBERTY-BP’을 비롯해, 노바티스의 생물학적제제 졸레어(오말리주맙)에 불응하거나 미경험인 만성 자발 두드러기(CSU) 환자 대상 3상 연구 ‘LIBERTY-CSU CUPID’과 2~12세 소아 환자 대상 3상 ‘LIBERTY-CSU CUPIDKids’가 포함된다.이와 함께 호산구성 위염과 십이지장염 환자를 대상으로 한 2/3상 연구 ‘ENGAGE’, 원인불명 만성 소양증(CPUO) 성인 대상 3상 ‘LIBERTY-CPUO-CHIC’, 만성 단순 태선 환자를 대상으로 한 임상3상 ‘STYLE 1, 2’도 진행 중이다.또 사노피는 호산구성 표현형을 가진 중등증~중증 궤양성 대장염 환자를 대상으로 한 임상2상(LIBERTY-UC SUCCEED)도 진행하면서 피부·호흡기 질환을 넘어 위장관·알레르기 질환 등 다양한 영역으로 임상 범위를 넓히고 있다.사노피는 “8건의 적응증 확대 임상을 통해 듀피젠트를 장기 성장동력으로 육성하겠다”며 “미충족 수요가 높은 질환에서 새로운 치료 옵션을 제시하는 것이 목표”라고 밝혔다.2025-08-04 12:00:28손형민 -
 유한양행 기술수출 퇴행성디스크 신약 임상3상 고배[데일리팜=손형민 기자] 엔솔바이오사이언스가 개발한 퇴행성 디스크병(DDD) 치료제의 글로벌 임상 3상이 실패로 돌아갔다. 다만 특정 하위 집단 분석에서 위약 대비 개선 효과가 확인돼 회사는 후속 전략 마련에 나서겠다는 계획이다.4일 미국 스파인바이오파마가 최근 공개한 임상3상 탑라인 결과에 따르면, 디스크병 치료제 후보물질 ‘SB-01’이 임상 3상 연구에서 1차 평가변수를 충족하지 못했다. SB-01은 엔솔바이오가 개발해 2009년 유한양행에 기술이전했고 유한양행이 2018년 스파인바이오파마로 글로벌 임상 권리를 넘긴 파이프라인이다.SB-01은 합성 7아미노산 펩타이드로, 변성된 추간판(Intervertebral disc)에서 과발현되는 전환성장인자베타1(TGFβ1)에 결합해 발현을 낮추는 기전을 가진다. TGFβ1의 비정상 신호전달은 추간판 구조를 유지하는 세포외기질 성분의 분해와 관련이 있으며, 신경성장인자(NGF) 발현을 촉진해 감각신경 수를 늘리고 디스크성 통증을 유발하는 것으로 알려져 있다.스파인바이오파마는 SB-01을 추간판 내 직접 주사해 통증·기능장애를 개선하고, 디스크 변성 진행을 억제하는 ‘혁신신약(First-in-Class)’ 치료 전략으로 개발해 왔다.MODEL로 명명된 임상 3상은 미국 내 30개 기관에서 퇴행성 디스크병(DDD)에 의한 중등증~중증 만성 요통 환자 417명을 대상으로 SB-01과 위약군의 유효성, 안전성을 비교한 연구다.1차 평가변수는 NRS(통증 척도) 2점 이상·ODI(기능 장애 지수) 15점 이상 개선(복합 지표), 2차 평가변수에는 ODI 단독 개선률이 포함됐다.임상 결과, SB-01은 6개월 시점 NRS·ODI 복합 지표에서 위약 대비 개선 효과를 보였으나, p값은 0.051로 통계적 기준에는 미달했다. 다만 회사 측은 SB-01 투여군의 복합 성공률은 67%였으며, 이는 임상적으로는 의미 있는 수준이라고 설명했다.스파인바이오파마 측은 위약군 반응률 급등이 임상 실패의 주요 원인이라고 설명했다.프란 메이지 스파인바이오파마 CTO는 “SB-01 환자군은 예상대로 반응했지만, 위약군 반응률이 2상 대비 비정상적으로 높았다”며 “특히 일부 기관에서 기대치를 크게 웃도는 위약 효과가 나타나 통계적 유의성 확보에 장애가 됐다”고 말했다.실제로 기관 간 위약군 반응률 편차가 컸으며, 2상에서 기대했던 수준의 위약 반응률을 보인 기관(227명)만 분석한 결과, SB-01군의 복합 성공률은 70%로 위약군(59%)보다 높았고(p=0.051), ODI 단독 지표에서도 SB-01군이 79%로 위약군(69%) 대비 유의한 차이를 보였다(p=0.040).마크 비스콜리오시 스파인바이오파마 CEO는 “예상했던 위약 반응률만 유지됐다면 통계적으로 유의한 결과를 얻었을 것”이라며 “엄격한 FDA 가이드라인하에 완성도 높은 시험을 수행했다는 점에서 의미가 크다”고 평가했다.스파인바이오파마는 이번 결과를 토대로 추가 분석과 후속 개발 계획을 검토 중이다.2025-08-04 12:00:18손형민
유한양행 기술수출 퇴행성디스크 신약 임상3상 고배[데일리팜=손형민 기자] 엔솔바이오사이언스가 개발한 퇴행성 디스크병(DDD) 치료제의 글로벌 임상 3상이 실패로 돌아갔다. 다만 특정 하위 집단 분석에서 위약 대비 개선 효과가 확인돼 회사는 후속 전략 마련에 나서겠다는 계획이다.4일 미국 스파인바이오파마가 최근 공개한 임상3상 탑라인 결과에 따르면, 디스크병 치료제 후보물질 ‘SB-01’이 임상 3상 연구에서 1차 평가변수를 충족하지 못했다. SB-01은 엔솔바이오가 개발해 2009년 유한양행에 기술이전했고 유한양행이 2018년 스파인바이오파마로 글로벌 임상 권리를 넘긴 파이프라인이다.SB-01은 합성 7아미노산 펩타이드로, 변성된 추간판(Intervertebral disc)에서 과발현되는 전환성장인자베타1(TGFβ1)에 결합해 발현을 낮추는 기전을 가진다. TGFβ1의 비정상 신호전달은 추간판 구조를 유지하는 세포외기질 성분의 분해와 관련이 있으며, 신경성장인자(NGF) 발현을 촉진해 감각신경 수를 늘리고 디스크성 통증을 유발하는 것으로 알려져 있다.스파인바이오파마는 SB-01을 추간판 내 직접 주사해 통증·기능장애를 개선하고, 디스크 변성 진행을 억제하는 ‘혁신신약(First-in-Class)’ 치료 전략으로 개발해 왔다.MODEL로 명명된 임상 3상은 미국 내 30개 기관에서 퇴행성 디스크병(DDD)에 의한 중등증~중증 만성 요통 환자 417명을 대상으로 SB-01과 위약군의 유효성, 안전성을 비교한 연구다.1차 평가변수는 NRS(통증 척도) 2점 이상·ODI(기능 장애 지수) 15점 이상 개선(복합 지표), 2차 평가변수에는 ODI 단독 개선률이 포함됐다.임상 결과, SB-01은 6개월 시점 NRS·ODI 복합 지표에서 위약 대비 개선 효과를 보였으나, p값은 0.051로 통계적 기준에는 미달했다. 다만 회사 측은 SB-01 투여군의 복합 성공률은 67%였으며, 이는 임상적으로는 의미 있는 수준이라고 설명했다.스파인바이오파마 측은 위약군 반응률 급등이 임상 실패의 주요 원인이라고 설명했다.프란 메이지 스파인바이오파마 CTO는 “SB-01 환자군은 예상대로 반응했지만, 위약군 반응률이 2상 대비 비정상적으로 높았다”며 “특히 일부 기관에서 기대치를 크게 웃도는 위약 효과가 나타나 통계적 유의성 확보에 장애가 됐다”고 말했다.실제로 기관 간 위약군 반응률 편차가 컸으며, 2상에서 기대했던 수준의 위약 반응률을 보인 기관(227명)만 분석한 결과, SB-01군의 복합 성공률은 70%로 위약군(59%)보다 높았고(p=0.051), ODI 단독 지표에서도 SB-01군이 79%로 위약군(69%) 대비 유의한 차이를 보였다(p=0.040).마크 비스콜리오시 스파인바이오파마 CEO는 “예상했던 위약 반응률만 유지됐다면 통계적으로 유의한 결과를 얻었을 것”이라며 “엄격한 FDA 가이드라인하에 완성도 높은 시험을 수행했다는 점에서 의미가 크다”고 평가했다.스파인바이오파마는 이번 결과를 토대로 추가 분석과 후속 개발 계획을 검토 중이다.2025-08-04 12:00:18손형민 -
 손 습진 치료제 등장...진화하는 차세대 바이오의약품[데일리팜=손형민 기자] 투여 편의성을 높인 바르는 야누스키나제(JAK) 억제제가 손 습진 치료 시장에 처음으로 진입했다. 기존 경구제 대비 부작용 부담을 줄이면서도 치료 접근성을 높인 것이 특징이다. 아토피·천식 등 염증질환에 쓰이는 생물학적제제들도 손 습진 적응증 확보를 위한 임상을 본격화하며 경쟁 구도에 뛰어들고 있다.레오파마 바르는 JAK 억제제 '앤줍고'2일 관련 업계에 따르면 미국 식품의약국(FDA)은 최근 레오파마의 ‘앤줍고(Anzupgo·성분명 델고시티닙)’를 중등증에서 중증 만성 손 습진(CHE) 치료제로 승인했다. 이번 허가로 앤줍고는 2020년 일본, 지난해 유럽에 이어 세번째 시장 진출에 성공했다. 국내에서도 현재 앤줍고의 품목 허가 심사가 진행 중이다. 회사에 따르면 국내 허가 예상시점은 9월이다.레오파마는 지난 2014년 일본 토바코사로부터 앤줍고의 개발 권리를 확보했으며, 일본을 제외한 전 세계 상용화 권리를 갖고 있다. 미국에서 국소 JAK 억제제가 허가된 것은 이번이 두 번째로, 앞서 2021년 인사이트의 ‘옵젤루라 크림’이 아토피피부염 치료제로 승인된 바 있다.앤줍고는 크림 제형으로 JAK1·2·3과 티로신키나제2(TYK2)를 동시에 억제한다. 특히 TYK2는 건선 등 피부질환에서 핵심적으로 작용하는 인터루킨(IL)-23 신호 전달 경로의 연결고리 역할을 한다.만성 손 습진은 손에 붉은 반점, 갈라짐, 가려움, 통증 등을 유발하는 염증성 피부질환이다. 물·세제·알레르기 반응·스트레스 등에 의해 악화되며, 심한 경우 일상생활이 어렵다. 국내에서는 ‘주부습진’으로도 불린다.현재 만성 손 습진 치료제 시장은 선택지가 제한적이다. 경구제인 GSK의 톡티노가 사실상 유일한 옵션이지만, 12주 복용 권장과 간 기능 이상 등 부작용으로 장기 사용이 어렵다. 이에 피부과 전문의들은 꾸준히 새로운 치료제 필요성을 제기해 왔다.지난 3월 미국피부과학회에서 공개된 연구에 따르면 앤줍고는 DELTA 1·2 임상에서 환자의 48%가 16주 이내 깊은 반응(Deep Response)을 얻었으며, 24% 이상은 지속적 반응을 보였다. 약 33% 환자는 치료 중단 후에도 효과를 유지했다.앤줍고는 톡티노와의 1대1 비교 임상에서도 12주 차 손 습진 중증도 지수(HECSI) 개선에서 더 큰 폭의 감소율을 기록했다. 360점 척도 기준 앤줍고 투여군은 67.6점 감소, 톡티노 투여군은 51.5점 감소로 유의한 차이가 났다. 부작용은 국소 홍반·자극 등 경미한 수준에 그쳤고, 경구제에서 흔히 보고되는 간 기능 이상 등 전신 부작용은 드물었다. JAK억제제뿐만 아니라 생물학적제제도 손습진 시장 겨냥사노피·리제네론 '듀피젠트'레오파마뿐만 아니라 사노피, 리제네론 등이 손습진 시장을 타깃해 임상을 진행 중이다.사노피와 리제네론은 기 상용화된 듀피젠트를 통해 임상 연구를 진행하고 있다. 듀피젠트는 2형 염증의 주요 원인 물질인 IL-4, 13의 신호 전달을 표적하는 최초의 생물의약품이다. 이에 염증이 원인인 천식·아토피피부염, 호산구성식도염 등에서 효과를 보이고 있다.최근 발표된 총 374명의 손 습진 환자를 대상으로 진행한 메타분석에서 듀피젠트를 투여한 결과, 4~16주 이내에 환자의 약 80%에서 손 습진 증상이 부분적으로 호전되거나 완전히 사라졌다. 특히 수포형, 접촉성, 아토피형 손 습진에서 높은 반응률을 보였다. 각질형에서는 상대적으로 효과가 낮게 나타났다.치료 효과는 손 습진 중증도 지수뿐 아니라 삶의 질(QoL) 지표 개선에서도 뚜렷했다. 기존 아토피피부염 병력이 있는 환자에서 개선 폭이 더 컸으며, 가장 흔한 부작용은 결막염(9.9%), 단순포진 감염(1.4%), 안면 홍반(1.3%) 등으로 보고됐다.사노피는 만성 손 습진 치료제 라인업 확대를 위해 구사시티닙(gusacitinib) 개발에도 속도를 내고 있다.사노피는 지난해 포메이션 바이오로부터 5억4500만 유로(약 7200억원)를 지불하고 구사시티닙의 글로벌 개발 권리를 확보했으며, 현재 임상3상이 진행되고 있다.구사시티닙은 경구 투여가 가능한 이중 JAK/비장 티로신 인산화효소(SYK) 억제제로, JAK 경로 차단을 통한 염증 억제와 SYK 억제를 통한 면역세포 활성 억제를 동시에 겨냥한다. 이 복합 기전은 기존 단일 JAK 억제제보다 더 폭넓은 염증 조절 효과를 기대할 수 있다는 평가를 받는다. 앞서 진행된 임상2상에서는 구사시티닙 투여 시 HECSI 개선과 가려움 완화 효과가 확인됐다.사노피는 구사시티닙을 통해 손 습진뿐 아니라 향후 신규 염증질환 적응증 확장도 검토 중이다.2025-08-02 06:18:16손형민
손 습진 치료제 등장...진화하는 차세대 바이오의약품[데일리팜=손형민 기자] 투여 편의성을 높인 바르는 야누스키나제(JAK) 억제제가 손 습진 치료 시장에 처음으로 진입했다. 기존 경구제 대비 부작용 부담을 줄이면서도 치료 접근성을 높인 것이 특징이다. 아토피·천식 등 염증질환에 쓰이는 생물학적제제들도 손 습진 적응증 확보를 위한 임상을 본격화하며 경쟁 구도에 뛰어들고 있다.레오파마 바르는 JAK 억제제 '앤줍고'2일 관련 업계에 따르면 미국 식품의약국(FDA)은 최근 레오파마의 ‘앤줍고(Anzupgo·성분명 델고시티닙)’를 중등증에서 중증 만성 손 습진(CHE) 치료제로 승인했다. 이번 허가로 앤줍고는 2020년 일본, 지난해 유럽에 이어 세번째 시장 진출에 성공했다. 국내에서도 현재 앤줍고의 품목 허가 심사가 진행 중이다. 회사에 따르면 국내 허가 예상시점은 9월이다.레오파마는 지난 2014년 일본 토바코사로부터 앤줍고의 개발 권리를 확보했으며, 일본을 제외한 전 세계 상용화 권리를 갖고 있다. 미국에서 국소 JAK 억제제가 허가된 것은 이번이 두 번째로, 앞서 2021년 인사이트의 ‘옵젤루라 크림’이 아토피피부염 치료제로 승인된 바 있다.앤줍고는 크림 제형으로 JAK1·2·3과 티로신키나제2(TYK2)를 동시에 억제한다. 특히 TYK2는 건선 등 피부질환에서 핵심적으로 작용하는 인터루킨(IL)-23 신호 전달 경로의 연결고리 역할을 한다.만성 손 습진은 손에 붉은 반점, 갈라짐, 가려움, 통증 등을 유발하는 염증성 피부질환이다. 물·세제·알레르기 반응·스트레스 등에 의해 악화되며, 심한 경우 일상생활이 어렵다. 국내에서는 ‘주부습진’으로도 불린다.현재 만성 손 습진 치료제 시장은 선택지가 제한적이다. 경구제인 GSK의 톡티노가 사실상 유일한 옵션이지만, 12주 복용 권장과 간 기능 이상 등 부작용으로 장기 사용이 어렵다. 이에 피부과 전문의들은 꾸준히 새로운 치료제 필요성을 제기해 왔다.지난 3월 미국피부과학회에서 공개된 연구에 따르면 앤줍고는 DELTA 1·2 임상에서 환자의 48%가 16주 이내 깊은 반응(Deep Response)을 얻었으며, 24% 이상은 지속적 반응을 보였다. 약 33% 환자는 치료 중단 후에도 효과를 유지했다.앤줍고는 톡티노와의 1대1 비교 임상에서도 12주 차 손 습진 중증도 지수(HECSI) 개선에서 더 큰 폭의 감소율을 기록했다. 360점 척도 기준 앤줍고 투여군은 67.6점 감소, 톡티노 투여군은 51.5점 감소로 유의한 차이가 났다. 부작용은 국소 홍반·자극 등 경미한 수준에 그쳤고, 경구제에서 흔히 보고되는 간 기능 이상 등 전신 부작용은 드물었다. JAK억제제뿐만 아니라 생물학적제제도 손습진 시장 겨냥사노피·리제네론 '듀피젠트'레오파마뿐만 아니라 사노피, 리제네론 등이 손습진 시장을 타깃해 임상을 진행 중이다.사노피와 리제네론은 기 상용화된 듀피젠트를 통해 임상 연구를 진행하고 있다. 듀피젠트는 2형 염증의 주요 원인 물질인 IL-4, 13의 신호 전달을 표적하는 최초의 생물의약품이다. 이에 염증이 원인인 천식·아토피피부염, 호산구성식도염 등에서 효과를 보이고 있다.최근 발표된 총 374명의 손 습진 환자를 대상으로 진행한 메타분석에서 듀피젠트를 투여한 결과, 4~16주 이내에 환자의 약 80%에서 손 습진 증상이 부분적으로 호전되거나 완전히 사라졌다. 특히 수포형, 접촉성, 아토피형 손 습진에서 높은 반응률을 보였다. 각질형에서는 상대적으로 효과가 낮게 나타났다.치료 효과는 손 습진 중증도 지수뿐 아니라 삶의 질(QoL) 지표 개선에서도 뚜렷했다. 기존 아토피피부염 병력이 있는 환자에서 개선 폭이 더 컸으며, 가장 흔한 부작용은 결막염(9.9%), 단순포진 감염(1.4%), 안면 홍반(1.3%) 등으로 보고됐다.사노피는 만성 손 습진 치료제 라인업 확대를 위해 구사시티닙(gusacitinib) 개발에도 속도를 내고 있다.사노피는 지난해 포메이션 바이오로부터 5억4500만 유로(약 7200억원)를 지불하고 구사시티닙의 글로벌 개발 권리를 확보했으며, 현재 임상3상이 진행되고 있다.구사시티닙은 경구 투여가 가능한 이중 JAK/비장 티로신 인산화효소(SYK) 억제제로, JAK 경로 차단을 통한 염증 억제와 SYK 억제를 통한 면역세포 활성 억제를 동시에 겨냥한다. 이 복합 기전은 기존 단일 JAK 억제제보다 더 폭넓은 염증 조절 효과를 기대할 수 있다는 평가를 받는다. 앞서 진행된 임상2상에서는 구사시티닙 투여 시 HECSI 개선과 가려움 완화 효과가 확인됐다.사노피는 구사시티닙을 통해 손 습진뿐 아니라 향후 신규 염증질환 적응증 확장도 검토 중이다.2025-08-02 06:18:16손형민 -
 키트루다, 분기 매출 10조원...글로벌 항암제 시장 독주[데일리팜=손형민 기자] 미국 MSD의 면역항암제 키트루다가 분기 매출 10조원 이상을 기록하며 글로벌 항암제 시장에서 독보적인 입지를 입증했다. 키트루다는 미국·유럽·한국을 비롯한 주요국에서 적응증 확대가 빠르게 진행되면서 성장세를 유지했다. MSD는 키트루다의 피하주사(SC) 제형 허가도 추진하며 특허만료 이후 시장 방어 전략도 본격화하고 있다.1일 MSD 글로벌 실적 자료에 따르면 키트루다는 지난 2분기 매출 79억5600만 달러(약 11조원)를 기록하며 전년 동기 대비 9.4% 늘었다. 키트루다의 상반기 매출은 지난해 142억1700만 달러에서 올해 151억6100만 달러(약 21조원)로 6.6% 증가했다.키트루다는 MSD가 개발한 면역항암제로 주요 고형암에서 발현되는 PD-L1 바이오마커를 타깃한다. 이 항암제는 적응증 확대와 각종 표적항암제 항체약물접합체(ADC) 병용요법 허가가 지속되며 시장 지배력을 공고히 해왔다. 키트루다는 지난 2021년 1분기 38억 9900만 달러를 기록한 15분기 연속 매출이 늘어났다. 키트루다는 같은해 2분기 매출 40억 달러를 돌파했다. 이후 성장세를 거듭한 키트루다는 2022년 2분기 매출 50억 달러(약 6조9000억원) 이상을 기록했다.키트루다 매출 상승세는 2023년과 2024년에도 계속됐다. 이 항암제는 2023년 1분기 57억 9500만 달러를 기록한 같은해 2분기 60억 달러를 돌파했다. 지난해 2분기에는 처음으로 70억 달러(약 9조 6600억원)를 돌파하며 MSD의 매출을 견인하는 초대형 블록버스터 의약품으로 성장했다.키트루다는 지난해 4분기 매출 78억3600만 달러를 기록한 이후 올해 1분기 처음으로 매출이 감소했지만, 지난해 2분기 이후 분기 매출 70억 달러(약 9조5000억원) 이상을 유지하고 있다.연도별로 살펴봐도 성장세는 두드러진다. 키트루다는 2019년 100억 달러(약 13조3000억원)를 돌파한 이후 성장세를 거듭하며 2022년 200억 달러(약 26조 7000억원) 매출을 돌파했다. 키트루다는 지난해 매출 294억8200만 달러를 기록했는데, 이는 2020년 매출과 비교하면 105% 늘어난 수치다. 올해는 연매출 300억 달러(약 41조원) 돌파가 유력하다.주요 고형암서 허가…피하주사 제형으로 특허 만료 방어나서MSD 면역항암제 '키트루다'키트루다는 현재 글로벌 항암제 시장 매출 선두 의약품이다. 국내에서도 단일 품목 기준 의약품 매출 선두를 차지하고 있으며, 주요 적응증이 포진된 폐암, 위암, 유방암 등 고형암 치료에서 표준요법으로 자리 잡고 있다.키트루다가 면역항암제 시장에서 독보적 매출 1위 자리를 지키는 배경에는 적응증 확장 전략이 있다. MSD는 2014년 9월 미국 식품의약국(FDA)으로부터 흑색종 치료제로 키트루다를 처음 승인받은 뒤, 이후 약 10년간 40개 이상의 적응증을 확보하며 치료범위를 넓혀왔다.특히 키트루다는 단순 암종 확대에 그치지 않고, 바이오마커 기반 허가를 통해 정밀의료 흐름을 주도했다. 2017년에는 고빈도 현미 부수체 불안정성(MSI-H) 또는 불일치 복구결함(dMMR)에 대해 암종 불문 항암제로 처음 FDA 허가를 받으며, 종양의 유전자 특성에 따라 약물을 선택하는 치료 패러다임을 본격화했다. MSI-H는 DNA 복제 과정에서 생긴 오류를 복구하는 유전체인 MMR에 결함이 생김으로써 DNA 염기 서열 길이에 이상이 생긴 상태를 의미한다.초기에는 흑색종, 폐암, 방광암 등 소수 암종에 집중됐던 키트루다는 이후 유방암, 자궁경부암, 식도암, 담도암 등으로 치료 범위를 넓혀나갔다. 폐암만 놓고 보더라도 단독요법, 항암화학요법 병용 등 다양한 투여 전략을 확보하고 있다. 요로상피암에서는 ADC 항암제 파드셉과의 병용 투여도 가능하다. 최근에는 다양한 파트너사와의 병용요법 중심으로 임상을 확대하고 있다.MSD는 2029년 미국 물질 특허 만료를 대비해 키트루다의 SC제 형을 준비 중이다. 이 회사는 지난 1월 미국 FDA에 키트루다 SC 제형의 허가 신청을 완료했으며, 오는 9월 23일까지 승인 여부가 결정된다. 허가가 이뤄질 경우 면역항암제 투여 환경은 큰 변화를 맞게 된다.정맥주사(IV) 제형이 표준인 항암제 시장에서 SC 제형은 환자 편의성과 병원 내 투약 회전율을 크게 높일 수 있다. SC 제형은 통상 1시간 이상 소요되는 IV 투여 시간을 단축할 수 있다는 강점이 있다.MSD는 이번 SC 제형 개발에 있어 국내 기업 알테오젠의 ‘인간 히알루로니다제’ 기술을 적용했다. 이 기술은 피하조직의 히알루론산을 분해해 약물 흡수를 돕는 기전으로, 고분자 의약품을 SC 제형으로 전환하는 핵심 플랫폼 중 하나로 꼽힌다.최근 공개된 임상 결과에서도 SC 제형은 IV 제형과 유사한 유효성·안전성을 입증했다. 4기 비소세포폐암 환자 377명을 대상으로 한 임상에서, 객관적 반응률(ORR)은 SC군 45.1%, IV군 42.1%로 나타났고, 무진행생존기간(PFS)도 SC군 8.1개월, IV군 7.8개월로 유사했다. 이상반응으로 인한 투여 중단율 역시 두 군 모두 약 8%대로 차이를 보이지 않았다.현재 국내외에서 주요 제약바이오기어빙 키트루다 기반 병용요법 임상을 진행 중인 만큼, SC 제형이 승인될 경우 병용 전략의 구도가 바뀔 수 있다는 평가가 지배적이다.2025-08-01 12:00:03손형민
키트루다, 분기 매출 10조원...글로벌 항암제 시장 독주[데일리팜=손형민 기자] 미국 MSD의 면역항암제 키트루다가 분기 매출 10조원 이상을 기록하며 글로벌 항암제 시장에서 독보적인 입지를 입증했다. 키트루다는 미국·유럽·한국을 비롯한 주요국에서 적응증 확대가 빠르게 진행되면서 성장세를 유지했다. MSD는 키트루다의 피하주사(SC) 제형 허가도 추진하며 특허만료 이후 시장 방어 전략도 본격화하고 있다.1일 MSD 글로벌 실적 자료에 따르면 키트루다는 지난 2분기 매출 79억5600만 달러(약 11조원)를 기록하며 전년 동기 대비 9.4% 늘었다. 키트루다의 상반기 매출은 지난해 142억1700만 달러에서 올해 151억6100만 달러(약 21조원)로 6.6% 증가했다.키트루다는 MSD가 개발한 면역항암제로 주요 고형암에서 발현되는 PD-L1 바이오마커를 타깃한다. 이 항암제는 적응증 확대와 각종 표적항암제 항체약물접합체(ADC) 병용요법 허가가 지속되며 시장 지배력을 공고히 해왔다. 키트루다는 지난 2021년 1분기 38억 9900만 달러를 기록한 15분기 연속 매출이 늘어났다. 키트루다는 같은해 2분기 매출 40억 달러를 돌파했다. 이후 성장세를 거듭한 키트루다는 2022년 2분기 매출 50억 달러(약 6조9000억원) 이상을 기록했다.키트루다 매출 상승세는 2023년과 2024년에도 계속됐다. 이 항암제는 2023년 1분기 57억 9500만 달러를 기록한 같은해 2분기 60억 달러를 돌파했다. 지난해 2분기에는 처음으로 70억 달러(약 9조 6600억원)를 돌파하며 MSD의 매출을 견인하는 초대형 블록버스터 의약품으로 성장했다.키트루다는 지난해 4분기 매출 78억3600만 달러를 기록한 이후 올해 1분기 처음으로 매출이 감소했지만, 지난해 2분기 이후 분기 매출 70억 달러(약 9조5000억원) 이상을 유지하고 있다.연도별로 살펴봐도 성장세는 두드러진다. 키트루다는 2019년 100억 달러(약 13조3000억원)를 돌파한 이후 성장세를 거듭하며 2022년 200억 달러(약 26조 7000억원) 매출을 돌파했다. 키트루다는 지난해 매출 294억8200만 달러를 기록했는데, 이는 2020년 매출과 비교하면 105% 늘어난 수치다. 올해는 연매출 300억 달러(약 41조원) 돌파가 유력하다.주요 고형암서 허가…피하주사 제형으로 특허 만료 방어나서MSD 면역항암제 '키트루다'키트루다는 현재 글로벌 항암제 시장 매출 선두 의약품이다. 국내에서도 단일 품목 기준 의약품 매출 선두를 차지하고 있으며, 주요 적응증이 포진된 폐암, 위암, 유방암 등 고형암 치료에서 표준요법으로 자리 잡고 있다.키트루다가 면역항암제 시장에서 독보적 매출 1위 자리를 지키는 배경에는 적응증 확장 전략이 있다. MSD는 2014년 9월 미국 식품의약국(FDA)으로부터 흑색종 치료제로 키트루다를 처음 승인받은 뒤, 이후 약 10년간 40개 이상의 적응증을 확보하며 치료범위를 넓혀왔다.특히 키트루다는 단순 암종 확대에 그치지 않고, 바이오마커 기반 허가를 통해 정밀의료 흐름을 주도했다. 2017년에는 고빈도 현미 부수체 불안정성(MSI-H) 또는 불일치 복구결함(dMMR)에 대해 암종 불문 항암제로 처음 FDA 허가를 받으며, 종양의 유전자 특성에 따라 약물을 선택하는 치료 패러다임을 본격화했다. MSI-H는 DNA 복제 과정에서 생긴 오류를 복구하는 유전체인 MMR에 결함이 생김으로써 DNA 염기 서열 길이에 이상이 생긴 상태를 의미한다.초기에는 흑색종, 폐암, 방광암 등 소수 암종에 집중됐던 키트루다는 이후 유방암, 자궁경부암, 식도암, 담도암 등으로 치료 범위를 넓혀나갔다. 폐암만 놓고 보더라도 단독요법, 항암화학요법 병용 등 다양한 투여 전략을 확보하고 있다. 요로상피암에서는 ADC 항암제 파드셉과의 병용 투여도 가능하다. 최근에는 다양한 파트너사와의 병용요법 중심으로 임상을 확대하고 있다.MSD는 2029년 미국 물질 특허 만료를 대비해 키트루다의 SC제 형을 준비 중이다. 이 회사는 지난 1월 미국 FDA에 키트루다 SC 제형의 허가 신청을 완료했으며, 오는 9월 23일까지 승인 여부가 결정된다. 허가가 이뤄질 경우 면역항암제 투여 환경은 큰 변화를 맞게 된다.정맥주사(IV) 제형이 표준인 항암제 시장에서 SC 제형은 환자 편의성과 병원 내 투약 회전율을 크게 높일 수 있다. SC 제형은 통상 1시간 이상 소요되는 IV 투여 시간을 단축할 수 있다는 강점이 있다.MSD는 이번 SC 제형 개발에 있어 국내 기업 알테오젠의 ‘인간 히알루로니다제’ 기술을 적용했다. 이 기술은 피하조직의 히알루론산을 분해해 약물 흡수를 돕는 기전으로, 고분자 의약품을 SC 제형으로 전환하는 핵심 플랫폼 중 하나로 꼽힌다.최근 공개된 임상 결과에서도 SC 제형은 IV 제형과 유사한 유효성·안전성을 입증했다. 4기 비소세포폐암 환자 377명을 대상으로 한 임상에서, 객관적 반응률(ORR)은 SC군 45.1%, IV군 42.1%로 나타났고, 무진행생존기간(PFS)도 SC군 8.1개월, IV군 7.8개월로 유사했다. 이상반응으로 인한 투여 중단율 역시 두 군 모두 약 8%대로 차이를 보이지 않았다.현재 국내외에서 주요 제약바이오기어빙 키트루다 기반 병용요법 임상을 진행 중인 만큼, SC 제형이 승인될 경우 병용 전략의 구도가 바뀔 수 있다는 평가가 지배적이다.2025-08-01 12:00:03손형민
오늘의 TOP 10
- 1상장 바이오 추정 순이익 '껑충'...비교군 한미약품 '최다'
- 2완강한 약무정책과장..."플랫폼 도매 허용 동의 힘들어"
- 3고환율에 복잡한 약가인하...사업계획 엄두 못내는 제약사들
- 4"대통령, 중대사고 엄벌 주문…제약업계도 대비해야"
- 5성과 증명한 강원호, 2대주주 등극…유나이티드 영향력 확대
- 6"웰컴"...K-약국, 해외관광객 소비건수 1년새 67% 증가
- 7[기자의 눈] ‘깜깜이’ 약가인하 혼란, 언제까지 반복할까
- 8수두백신 2회 접종 개발 본격화…SK바이오, 임상3상 승인
- 9사노피 '듀피젠트', 아토피피부염 넘어 천식 공략 눈앞
- 10[2025 결산] 급여재평가 희비...건보재정 적자터널 진입
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417














![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
