-
 동아참메드, 휴피트와 지분투자·독점 판매 계약[데일리팜=노병철 기자] 동아에스티의 자회사 동아참메드(대표이사 사장 정재훈)는 감염성질환 진단 특화기업 휴피트(HUFIT, 대표 박상열)와 지분투자 및 국내 독점 판매 계약을 체결했다고 8일 밝혔다.동아참메드는 이번 계약을 통해 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’ 등의 국내 독점 판매권을 확보했으며, 향후 휴피트에서 출시 예정인 결핵배양시스템 및 분자진단시스템 등 국내외 독점 판매에 대한 우선협상권을 확보했다.동아참메드는 휴피트와의 전략적 제휴를 통해 기존 체외진단 및 감염관리 사업 역량을 바탕으로 미생물진단 및 분자진단 분야 시장 진출을 본격화하고, 향후 공동 기술 개발에 협력할 예정이다.글로벌 산업 및 시장조사 전문 기관 ‘MarketsandMarkets’, ‘The Business Research Company’의 보고서에 따르면 글로벌 혈액배양검사 시장은 2025년 약 5조7천억 원, 결핵 진단시장은 2029년 약 3조5천 억원으로 성장이 전망된다. 국내 혈액배양검사 시장은 업계 추정에 따르면 약 650억 원 규모로 파악된다.휴피트는 감영성질환 진단 특화기업이다. 패혈증을 진단하는 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’를 개발해 유통하고 있다. 결핵배양시스템 ‘HubCentra TB’, 바이러스 및 항생제 내성균을 진단하는 분자진단시스템 ‘HuPectra’를 개발하고 있다.순수 국산 기술로 개발된 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’는 국내 최초이자 세계 두 번째로 전자동혈액배양 자동화 시스템을 갖췄다. 또한 국내 유통되는 제품 대비 검출 속도를 약 25% 향상시켰으며, 미생물단위로 검출 가능한 고감도를 갖춘 것이 특징이다.동아참메드 관계자는 “이번 제휴를 통해 동아참메드의 체외진단 및 감염관리 사업 역량에 휴피트의 혁신 기술이 더해져 시너지를 극대화할 수 있게 됐다”며 “국산 기술 기반의 진단 솔루션을 시장에 안정적으로 공급하고 양사의 경쟁력도 함께 강화해 나가겠다”고 말했다.휴피트 관계자는 “국내 최초로 글로벌 제품에 필적하는 성능의 혈액배양시스템을 개발했으며, 본격적인 시장진입을 위한 마케팅 및 영업 파트너가 필요한 상황에서 우수한 역량과 경험을 갖춘 동아참메드와의 투자 및 총판계약은 양사 간 시너지 극대화를 위한 전환점이 될 것이다”고 말했다.한편, 동아에스티 자회사 동아참메드는 ▲이비인후과용 진료장치, 의료용 영상 장치 등을 생산 및 판매, 수출하는 의료기기 사업부문 ▲채혈용 소모품, 체외진단의료기기 등의 체외진단 사업부문 ▲공간소독시스템, 내시경소독기, 전용소독제, 소독 티슈 등의 감염관리 사업부문을 전문적으로 하는 토탈 메디컬 헬스케어 전문 기업이다.2025-08-08 11:10:54노병철
동아참메드, 휴피트와 지분투자·독점 판매 계약[데일리팜=노병철 기자] 동아에스티의 자회사 동아참메드(대표이사 사장 정재훈)는 감염성질환 진단 특화기업 휴피트(HUFIT, 대표 박상열)와 지분투자 및 국내 독점 판매 계약을 체결했다고 8일 밝혔다.동아참메드는 이번 계약을 통해 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’ 등의 국내 독점 판매권을 확보했으며, 향후 휴피트에서 출시 예정인 결핵배양시스템 및 분자진단시스템 등 국내외 독점 판매에 대한 우선협상권을 확보했다.동아참메드는 휴피트와의 전략적 제휴를 통해 기존 체외진단 및 감염관리 사업 역량을 바탕으로 미생물진단 및 분자진단 분야 시장 진출을 본격화하고, 향후 공동 기술 개발에 협력할 예정이다.글로벌 산업 및 시장조사 전문 기관 ‘MarketsandMarkets’, ‘The Business Research Company’의 보고서에 따르면 글로벌 혈액배양검사 시장은 2025년 약 5조7천억 원, 결핵 진단시장은 2029년 약 3조5천 억원으로 성장이 전망된다. 국내 혈액배양검사 시장은 업계 추정에 따르면 약 650억 원 규모로 파악된다.휴피트는 감영성질환 진단 특화기업이다. 패혈증을 진단하는 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’를 개발해 유통하고 있다. 결핵배양시스템 ‘HubCentra TB’, 바이러스 및 항생제 내성균을 진단하는 분자진단시스템 ‘HuPectra’를 개발하고 있다.순수 국산 기술로 개발된 혈액배양시스템 ‘HubCentra FA’, ‘HubCentra A’는 국내 최초이자 세계 두 번째로 전자동혈액배양 자동화 시스템을 갖췄다. 또한 국내 유통되는 제품 대비 검출 속도를 약 25% 향상시켰으며, 미생물단위로 검출 가능한 고감도를 갖춘 것이 특징이다.동아참메드 관계자는 “이번 제휴를 통해 동아참메드의 체외진단 및 감염관리 사업 역량에 휴피트의 혁신 기술이 더해져 시너지를 극대화할 수 있게 됐다”며 “국산 기술 기반의 진단 솔루션을 시장에 안정적으로 공급하고 양사의 경쟁력도 함께 강화해 나가겠다”고 말했다.휴피트 관계자는 “국내 최초로 글로벌 제품에 필적하는 성능의 혈액배양시스템을 개발했으며, 본격적인 시장진입을 위한 마케팅 및 영업 파트너가 필요한 상황에서 우수한 역량과 경험을 갖춘 동아참메드와의 투자 및 총판계약은 양사 간 시너지 극대화를 위한 전환점이 될 것이다”고 말했다.한편, 동아에스티 자회사 동아참메드는 ▲이비인후과용 진료장치, 의료용 영상 장치 등을 생산 및 판매, 수출하는 의료기기 사업부문 ▲채혈용 소모품, 체외진단의료기기 등의 체외진단 사업부문 ▲공간소독시스템, 내시경소독기, 전용소독제, 소독 티슈 등의 감염관리 사업부문을 전문적으로 하는 토탈 메디컬 헬스케어 전문 기업이다.2025-08-08 11:10:54노병철 -
 의약품 허가·심사 조정협의체 운영 1년...신청 기한 확대[데일리팜=이혜경 기자] 식품의약품안전처가 지난해부터 '의약품 허가·심사 조정협의체'를 운영 중인 가운데, 심사 대상과 신청 기한을 확대하기로 했다.8일 관련업계에 따르면 식약처는 이 같은 내용을 담은 민원인 안내서 개정안을 마련하고 업계 의견조회를 진행하고 있다.조정협의체는 의약품 품목허가·심사 과정을 보다 투명하고 합리적으로 운영하기 위해 지난해 6월 마련됐으며, 의약품 품목허가·심사 과정에서 허가 신청 자료에 대한 보완을 요청하는 경우 신청인이 이에 대해 조정을 신청할 수 있도록 운영 중이다.의약품안전국장을 위원장으로 의약품심사부장, 의약품정책과장, 의약품허가총괄과장, 관련 심사부서 과장, 중앙약사심의위원회 전문가 등이 참여해 의결을 통해 조정을 진행하고 있다.의약품 허가·심사 조정협의체 운영안내서 개정(안). 지난 1년 동안 운영하면서 조정 신청 대상은 ▲안전성·유효성 심사자료 ▲품질 심사자료 ▲자료보호 대상 여부에 관한 자료에 한정했으나, 올해부터는 의약품허가총괄과에서 보완자료 제출을 요구한 '모든 사항'에 대해 조정신청을 진행할 수 있도록 확대할 계획이다.또 신청기한도 늘어난다.그동안 조정협의 신청은 보완요구일로부터 14일 이내 진행해야 했지만, 앞으로 최초 보완기간의 1/2시점까지로 확대된다. 예를 들어 보완기간이 60일이라면 조정협의신청은 30일 이내 신청할 수 있다.조정 대상으로 선정된 안건은 내외부 전문가로 구성된 조정협의체 회의에서 심도 깊은 토의를 거쳐 참석 위원의 3분의 2 이상 찬성으로 의결해 보완 사항에 대한 조정 결과를 도출하며, 조정 결과는 관련 부서 및 조정 신청인에게 통보된다.2025-08-08 11:04:40이혜경
의약품 허가·심사 조정협의체 운영 1년...신청 기한 확대[데일리팜=이혜경 기자] 식품의약품안전처가 지난해부터 '의약품 허가·심사 조정협의체'를 운영 중인 가운데, 심사 대상과 신청 기한을 확대하기로 했다.8일 관련업계에 따르면 식약처는 이 같은 내용을 담은 민원인 안내서 개정안을 마련하고 업계 의견조회를 진행하고 있다.조정협의체는 의약품 품목허가·심사 과정을 보다 투명하고 합리적으로 운영하기 위해 지난해 6월 마련됐으며, 의약품 품목허가·심사 과정에서 허가 신청 자료에 대한 보완을 요청하는 경우 신청인이 이에 대해 조정을 신청할 수 있도록 운영 중이다.의약품안전국장을 위원장으로 의약품심사부장, 의약품정책과장, 의약품허가총괄과장, 관련 심사부서 과장, 중앙약사심의위원회 전문가 등이 참여해 의결을 통해 조정을 진행하고 있다.의약품 허가·심사 조정협의체 운영안내서 개정(안). 지난 1년 동안 운영하면서 조정 신청 대상은 ▲안전성·유효성 심사자료 ▲품질 심사자료 ▲자료보호 대상 여부에 관한 자료에 한정했으나, 올해부터는 의약품허가총괄과에서 보완자료 제출을 요구한 '모든 사항'에 대해 조정신청을 진행할 수 있도록 확대할 계획이다.또 신청기한도 늘어난다.그동안 조정협의 신청은 보완요구일로부터 14일 이내 진행해야 했지만, 앞으로 최초 보완기간의 1/2시점까지로 확대된다. 예를 들어 보완기간이 60일이라면 조정협의신청은 30일 이내 신청할 수 있다.조정 대상으로 선정된 안건은 내외부 전문가로 구성된 조정협의체 회의에서 심도 깊은 토의를 거쳐 참석 위원의 3분의 2 이상 찬성으로 의결해 보완 사항에 대한 조정 결과를 도출하며, 조정 결과는 관련 부서 및 조정 신청인에게 통보된다.2025-08-08 11:04:40이혜경 -
 입냄새 싹! 동아제약 '듀오버스터민트볼' CU 입점[데일리팜=노병철 기자] 동아제약(대표이사 사장 백상환)은 ‘듀오 버스터 민트볼’이 CU에 입점했다고 8일 밝혔다.편의점 채널 중 최초로 CU에 입점, 올리브영에 이어 더욱 다양한 오프라인 매장에서 소비자들을 만나볼 수 있게 됐다.듀오 버스터 민트볼은 페퍼민트 에센스를 함유한 4.7mm의 액상 캡슐 형태의 구취 케어 제품으로, 섭취 시 입 안 가득 상쾌함을 선사한다.이 제품은 이중 캡슐 구조를 적용해 강력한 쿨링 효과를 제공하며, 얇은 커버링 기술을 통해 캡슐이 터질 때 껍질의 잔여감 없이 부드러운 목넘김이 가능하다.또한, 설탕이 첨가되지 않아 언제든 부담 없이 섭취할 수 있다.지난 4월 출시된 듀오 버스터 민트볼은 출시 직후품절 대란이 일어나는 등 소비자들로부터 큰 호응을 얻었다.동아제약 관계자는 “CU입점을 통해 더 많은 소비자와 만날 수 있게 되어 기쁘다”며 “차별화된 이중 캡슐 구조로 입안 가득 상쾌함을 전하는 ‘듀오 버스터 민트볼’을 다양한 일상 속에서 즐겨보시길 바란다”고 말했다.2025-08-08 10:55:40노병철
입냄새 싹! 동아제약 '듀오버스터민트볼' CU 입점[데일리팜=노병철 기자] 동아제약(대표이사 사장 백상환)은 ‘듀오 버스터 민트볼’이 CU에 입점했다고 8일 밝혔다.편의점 채널 중 최초로 CU에 입점, 올리브영에 이어 더욱 다양한 오프라인 매장에서 소비자들을 만나볼 수 있게 됐다.듀오 버스터 민트볼은 페퍼민트 에센스를 함유한 4.7mm의 액상 캡슐 형태의 구취 케어 제품으로, 섭취 시 입 안 가득 상쾌함을 선사한다.이 제품은 이중 캡슐 구조를 적용해 강력한 쿨링 효과를 제공하며, 얇은 커버링 기술을 통해 캡슐이 터질 때 껍질의 잔여감 없이 부드러운 목넘김이 가능하다.또한, 설탕이 첨가되지 않아 언제든 부담 없이 섭취할 수 있다.지난 4월 출시된 듀오 버스터 민트볼은 출시 직후품절 대란이 일어나는 등 소비자들로부터 큰 호응을 얻었다.동아제약 관계자는 “CU입점을 통해 더 많은 소비자와 만날 수 있게 되어 기쁘다”며 “차별화된 이중 캡슐 구조로 입안 가득 상쾌함을 전하는 ‘듀오 버스터 민트볼’을 다양한 일상 속에서 즐겨보시길 바란다”고 말했다.2025-08-08 10:55:40노병철 -
 급여 삭제 위기 명문·이노엔·대원·동아 간판 '흔들'[데일리팜=이탁순 기자] 급여 적정성 재평가 결과로 일부 제약사의 간판 품목들이 퇴출 위기에 놓였다.명문제약 간장약 '씨앤유캡슐'과 HK이노엔의 '크레메진', 동아ST의 '스티렌 투엑스정' 등이 대표적이다.여기에 후발주자로 높은 시장점유율을 기록한 대원 '레나메진', '오티렌F', 제일약품 '넥실렌 에스'도 직격탄을 맞았다.건강보험심사평가원 약제급여평가위원회는 8일 회의를 열고 20205년 급여적정성 재평가 대상 약제 중 구형흡착탄, 애엽추출물, 케노데속시콜산-우르데속시콜산삼이 임상적 유용성 근거가 없어 급여적정성이 없다고 판단했다.설글리코타이드도 급여적정성이 없다고 판단했지만, 임상적 유용성이 불분명하고 비용효과적이지 않아 추후 제약사가 자진 약가인하를 통해 급여 적정성을 인정받을 수 있는 기회가 있다.하지만 3개 성분 약제는 임상적 유용성 근거가 없다고 판단해 약가인하로도 급여 삭제를 막기는 어려울 전망이다.아직 제약사의 이의신청을 토대로 재심의가 남아있지만, 결과가 바뀌지 않는다면 이들 성분 약제는 급여목록에서 퇴출된다. 그러면 처방약 지위를 잃고 시장에서 경쟁력을 잃을 가능성이 크다.급여 퇴출 위기 블록버스터 주요 품목 실적(유비스트) 작년 재평가 대상 발표 당시 이들 성분의 급여 등재 품목수는 구형흡착탄이 2개사 3품목, 애엽추출물이 105개사 142품목, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 1개사 1품목이다.3년 평균 시장규모는 구형 흡착탄이 277억원, 애엽추출물이 1215억원, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염이 151억원이다.신장질환 환자의 투석 도입 지연 목적으로 사용되는 구형 흡착탄 품목은 오리지널 HK이노엔의 크레메진과 후발주자인 대원제약의 레나메진이 있다. 둘 다 100억원이 넘는 블록버스터 제품이다.유비스트 기준 2024년 원외처방액은 크레메진이 192억원, 레나메진이 173억원이다.위염 치료 용도로 사용되는 애엽추출물은 등재품목이 많은 만큼 실적이 높은 품목도 많다. 오리지널 품목(애엽95%에탄올연조엑스)을 보유한 동아ST의 스티렌 투엑스가 146억원, 스티렌 78억원으로 합치면 224억원에 달한다.스티렌의 용매를 바꾼 개량 약제(애엽이소프로판올연조엑스)인 대원제약 오티렌과 오티렌F도 각각 37억원, 87억원으로 합치면 124억원이다.제일약품 넥실렌 브랜드도 100억원이 넘는 블록버스터다. 넥실렌 에스는 82억원, 넥실렌은 34억원으로 합치면 연간 116억원의 규모다.오티렌과 넥실렌은 스티렌 개량약물로 식약처의 동동성 재평가는 피했지만, 이번 급여 재평가 대상에 포함돼 위기를 맞고 있다.간장약으로 많이 복용하는 케노데속시콜산우르데속시콜산삼수화물마그네슘염 제제는 명문제약의 씨앤유캡슐이 유일하다. 씨앤유는 단일 품목으로는 급여 퇴출 대상 중 처방액 규모가 가장 크다. 작년 199억원의 원외처방액을 기록했다.2025-08-08 10:49:07이탁순
급여 삭제 위기 명문·이노엔·대원·동아 간판 '흔들'[데일리팜=이탁순 기자] 급여 적정성 재평가 결과로 일부 제약사의 간판 품목들이 퇴출 위기에 놓였다.명문제약 간장약 '씨앤유캡슐'과 HK이노엔의 '크레메진', 동아ST의 '스티렌 투엑스정' 등이 대표적이다.여기에 후발주자로 높은 시장점유율을 기록한 대원 '레나메진', '오티렌F', 제일약품 '넥실렌 에스'도 직격탄을 맞았다.건강보험심사평가원 약제급여평가위원회는 8일 회의를 열고 20205년 급여적정성 재평가 대상 약제 중 구형흡착탄, 애엽추출물, 케노데속시콜산-우르데속시콜산삼이 임상적 유용성 근거가 없어 급여적정성이 없다고 판단했다.설글리코타이드도 급여적정성이 없다고 판단했지만, 임상적 유용성이 불분명하고 비용효과적이지 않아 추후 제약사가 자진 약가인하를 통해 급여 적정성을 인정받을 수 있는 기회가 있다.하지만 3개 성분 약제는 임상적 유용성 근거가 없다고 판단해 약가인하로도 급여 삭제를 막기는 어려울 전망이다.아직 제약사의 이의신청을 토대로 재심의가 남아있지만, 결과가 바뀌지 않는다면 이들 성분 약제는 급여목록에서 퇴출된다. 그러면 처방약 지위를 잃고 시장에서 경쟁력을 잃을 가능성이 크다.급여 퇴출 위기 블록버스터 주요 품목 실적(유비스트) 작년 재평가 대상 발표 당시 이들 성분의 급여 등재 품목수는 구형흡착탄이 2개사 3품목, 애엽추출물이 105개사 142품목, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 1개사 1품목이다.3년 평균 시장규모는 구형 흡착탄이 277억원, 애엽추출물이 1215억원, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염이 151억원이다.신장질환 환자의 투석 도입 지연 목적으로 사용되는 구형 흡착탄 품목은 오리지널 HK이노엔의 크레메진과 후발주자인 대원제약의 레나메진이 있다. 둘 다 100억원이 넘는 블록버스터 제품이다.유비스트 기준 2024년 원외처방액은 크레메진이 192억원, 레나메진이 173억원이다.위염 치료 용도로 사용되는 애엽추출물은 등재품목이 많은 만큼 실적이 높은 품목도 많다. 오리지널 품목(애엽95%에탄올연조엑스)을 보유한 동아ST의 스티렌 투엑스가 146억원, 스티렌 78억원으로 합치면 224억원에 달한다.스티렌의 용매를 바꾼 개량 약제(애엽이소프로판올연조엑스)인 대원제약 오티렌과 오티렌F도 각각 37억원, 87억원으로 합치면 124억원이다.제일약품 넥실렌 브랜드도 100억원이 넘는 블록버스터다. 넥실렌 에스는 82억원, 넥실렌은 34억원으로 합치면 연간 116억원의 규모다.오티렌과 넥실렌은 스티렌 개량약물로 식약처의 동동성 재평가는 피했지만, 이번 급여 재평가 대상에 포함돼 위기를 맞고 있다.간장약으로 많이 복용하는 케노데속시콜산우르데속시콜산삼수화물마그네슘염 제제는 명문제약의 씨앤유캡슐이 유일하다. 씨앤유는 단일 품목으로는 급여 퇴출 대상 중 처방액 규모가 가장 크다. 작년 199억원의 원외처방액을 기록했다.2025-08-08 10:49:07이탁순 -
 파마리서치메디케어, 건기식 약국 찾기 서비스 오픈[데일리팜=이석준 기자] 파마리서치메디케어(대표 서영재)는 약국 전용 건강기능식품 ‘관절엔 콘액트플러스’의 유통 약국 정보를 실시간으로 확인할 수 있는 ‘약국 찾기’ 서비스를 공식 오픈했다고 8일 밝혔다. 소비자 구매 접근성을 높이고, 신뢰할 수 있는 구매 채널을 제공하기 위해서다.약국 찾기 서비스는 ‘관절엔 콘액트플러스’ 공식 홈페이지를 통해 제공되며 소비자가 거주지 인근의 판매 약국을 손쉽게 찾을 수 있도록 설계됐다. 현재까지 약 500개 이상의 약국이 등록됐으며, 향후 입점약국을 늘려 서비스를 확대해나갈 예정이다.파마리서치메디케어 관계자는 “최근 ‘관절엔 콘액트플러스’에 대한 소비자 관심과 구매 문의가 급증하고 있다. 보다 많은 고객이 제품을 편리하게 접할 수 있도록 신뢰도 높은 유통망 확보에 주력할 계획”이라고 말했다.‘관절엔 콘액트 플러스’는 연어이리추출물(DOT 연어핵산), 비타민D, 망간 등 관절 기능 개선에 도움을 주는 복합 성분을 함유한 개별 인정형 건기식이다. 경구 섭취 방식으로 복용이 간편하며 ▲관절 통증 완화 ▲염증 개선 ▲연골 보호 등의 기능을 통해 일상 속에서 관절 건강을 관리하는데 효과적이다.한편 파마리서치메디케어는 지난해 파마리서치가 비에스테틱 제품의 판매 전문성 강화를 위해 설립한 자회사다. 주요 판매 품목은 관절강 주사 '콘쥬란', PDRN 점안제 ‘리안 점안액’, PDRN 크림 ‘리쥬비넥스크림’, 면역증강제 '자닥신', PDRN 오리지널 주사제 ‘플라센텍스’, 인체 콜라겐 주사 ‘세시엠 L’등이다.2025-08-08 09:06:10이석준
파마리서치메디케어, 건기식 약국 찾기 서비스 오픈[데일리팜=이석준 기자] 파마리서치메디케어(대표 서영재)는 약국 전용 건강기능식품 ‘관절엔 콘액트플러스’의 유통 약국 정보를 실시간으로 확인할 수 있는 ‘약국 찾기’ 서비스를 공식 오픈했다고 8일 밝혔다. 소비자 구매 접근성을 높이고, 신뢰할 수 있는 구매 채널을 제공하기 위해서다.약국 찾기 서비스는 ‘관절엔 콘액트플러스’ 공식 홈페이지를 통해 제공되며 소비자가 거주지 인근의 판매 약국을 손쉽게 찾을 수 있도록 설계됐다. 현재까지 약 500개 이상의 약국이 등록됐으며, 향후 입점약국을 늘려 서비스를 확대해나갈 예정이다.파마리서치메디케어 관계자는 “최근 ‘관절엔 콘액트플러스’에 대한 소비자 관심과 구매 문의가 급증하고 있다. 보다 많은 고객이 제품을 편리하게 접할 수 있도록 신뢰도 높은 유통망 확보에 주력할 계획”이라고 말했다.‘관절엔 콘액트 플러스’는 연어이리추출물(DOT 연어핵산), 비타민D, 망간 등 관절 기능 개선에 도움을 주는 복합 성분을 함유한 개별 인정형 건기식이다. 경구 섭취 방식으로 복용이 간편하며 ▲관절 통증 완화 ▲염증 개선 ▲연골 보호 등의 기능을 통해 일상 속에서 관절 건강을 관리하는데 효과적이다.한편 파마리서치메디케어는 지난해 파마리서치가 비에스테틱 제품의 판매 전문성 강화를 위해 설립한 자회사다. 주요 판매 품목은 관절강 주사 '콘쥬란', PDRN 점안제 ‘리안 점안액’, PDRN 크림 ‘리쥬비넥스크림’, 면역증강제 '자닥신', PDRN 오리지널 주사제 ‘플라센텍스’, 인체 콜라겐 주사 ‘세시엠 L’등이다.2025-08-08 09:06:10이석준 -
 HK이노엔, 신약 '케이캡' 미국 3상 성공…"연내 허가 신청"HK이노엔 위식도역류질환 신약 케이캡 시리즈 (자료: HK이노엔) [데일리팜=차지현 기자] HK이노엔은 위식도 역류질환 신약 케이캡(성분명 테고프라잔)이 유지요법 미국 임상 3상에서 긍정적인 결과를 확보했다고 8일 밝혔다.HK이노엔의 파트너사 세벨라 파마슈티컬스는 미국 식품의약국(FDA) 신약허가 신청(NDA)을 위한 마지막 관문을 통과한 이번 결과를 바탕으로 4분기 중 미란성 식도염 및 비미란성 위식도 역류질환 적응증에 대한 FDA 허가 신청을 진행할 계획이다.HK이노엔에 따르면 세벨라는 7일(현지 시각) 30호 국산 신약 케이캡의 미란성 식도염(EE) 치료 후 유지 요법을 평가한 미국 3상 임상시험 'TRIUMpH'의 주요 결과(톱 라인)를 발표했다.이번 임상시험은 2021년 HK이노엔과 미국 기술이전 계약을 체결한 세벨라의 소화기 의약품 전문 계열사 브레인트리가 진행했다.임상은 최대 8주의 초기 치료 후 완전히 치유된 미란성 식도염(EE) 환자들을 대상으로 진행됐다. 환자들은 P-CAB(칼륨 경쟁적 위산분비억제제) 계열의 테고프라잔 100㎎, 테고프라잔 50㎎ 또는 PPI 계열의 란소프라졸 15㎎ 중 하나를 무작위 배정받아 24주 동안 유지요법 치료를 받았다.1차 평가 지표인 24주간 치료 효과 유지율(관해 유지율) 평가 결과, 전체 환자군(LA 등급 A~D)에서 테고프라잔 모든 용량군이 란소프라졸 투여군 대비 비열등성을 입증했을 뿐만 아니라 통계적으로도 우월한 결과를 보였다는 게 회사 측 설명이다.중등도 이상의 식도염(LA 등급 C~D)환자군에서는 테고프라잔 모든 용량군에서 란소프라졸 투여군 대비 의미 있는 개선이 확인됐으며, 테고프라잔 100㎎ 투여군에서는 통계적 우월성이 입증됐다.또 테고프라잔 두 용량 모두 24시간 가슴쓰림 없는 날 비율에서 란소프라졸 대비 비열등성을 확인했다. 이번 연구에서 개별 이상 반응 발생률은 3% 미만이었으며, 대부분 경미하고 일시적이었다.TRIUMpH 3상 연구 결과는 주요 학술지와 함께 세계적인 소화기 학회에서 소개될 예정이다.케이캡은 국내에서 2019년 3월 출시됐으며 올해 상반기까지 누적 8천101억 원의 처방실적을 기록했다.앨런 쿡 세벨라 대표는 테고프라잔이 "기존 치료제와 유사한 안전성 프로파일까지 갖춰 미국 환자들의 미충족 수요를 충족시킬 수 있는 혁신적 치료 옵션이 될 것"이라고 말했다.곽달원 HK이노엔 대표는 "세계 최대 의약품 시장인 미국 진출이 가시권에 들어섰다"며 "파트너사와 함께 미국 FDA 허가 신청이 순조롭게 진행될 수 있도록 최선을 다할 것"이라고 했다.2025-08-08 09:00:12차지현
HK이노엔, 신약 '케이캡' 미국 3상 성공…"연내 허가 신청"HK이노엔 위식도역류질환 신약 케이캡 시리즈 (자료: HK이노엔) [데일리팜=차지현 기자] HK이노엔은 위식도 역류질환 신약 케이캡(성분명 테고프라잔)이 유지요법 미국 임상 3상에서 긍정적인 결과를 확보했다고 8일 밝혔다.HK이노엔의 파트너사 세벨라 파마슈티컬스는 미국 식품의약국(FDA) 신약허가 신청(NDA)을 위한 마지막 관문을 통과한 이번 결과를 바탕으로 4분기 중 미란성 식도염 및 비미란성 위식도 역류질환 적응증에 대한 FDA 허가 신청을 진행할 계획이다.HK이노엔에 따르면 세벨라는 7일(현지 시각) 30호 국산 신약 케이캡의 미란성 식도염(EE) 치료 후 유지 요법을 평가한 미국 3상 임상시험 'TRIUMpH'의 주요 결과(톱 라인)를 발표했다.이번 임상시험은 2021년 HK이노엔과 미국 기술이전 계약을 체결한 세벨라의 소화기 의약품 전문 계열사 브레인트리가 진행했다.임상은 최대 8주의 초기 치료 후 완전히 치유된 미란성 식도염(EE) 환자들을 대상으로 진행됐다. 환자들은 P-CAB(칼륨 경쟁적 위산분비억제제) 계열의 테고프라잔 100㎎, 테고프라잔 50㎎ 또는 PPI 계열의 란소프라졸 15㎎ 중 하나를 무작위 배정받아 24주 동안 유지요법 치료를 받았다.1차 평가 지표인 24주간 치료 효과 유지율(관해 유지율) 평가 결과, 전체 환자군(LA 등급 A~D)에서 테고프라잔 모든 용량군이 란소프라졸 투여군 대비 비열등성을 입증했을 뿐만 아니라 통계적으로도 우월한 결과를 보였다는 게 회사 측 설명이다.중등도 이상의 식도염(LA 등급 C~D)환자군에서는 테고프라잔 모든 용량군에서 란소프라졸 투여군 대비 의미 있는 개선이 확인됐으며, 테고프라잔 100㎎ 투여군에서는 통계적 우월성이 입증됐다.또 테고프라잔 두 용량 모두 24시간 가슴쓰림 없는 날 비율에서 란소프라졸 대비 비열등성을 확인했다. 이번 연구에서 개별 이상 반응 발생률은 3% 미만이었으며, 대부분 경미하고 일시적이었다.TRIUMpH 3상 연구 결과는 주요 학술지와 함께 세계적인 소화기 학회에서 소개될 예정이다.케이캡은 국내에서 2019년 3월 출시됐으며 올해 상반기까지 누적 8천101억 원의 처방실적을 기록했다.앨런 쿡 세벨라 대표는 테고프라잔이 "기존 치료제와 유사한 안전성 프로파일까지 갖춰 미국 환자들의 미충족 수요를 충족시킬 수 있는 혁신적 치료 옵션이 될 것"이라고 말했다.곽달원 HK이노엔 대표는 "세계 최대 의약품 시장인 미국 진출이 가시권에 들어섰다"며 "파트너사와 함께 미국 FDA 허가 신청이 순조롭게 진행될 수 있도록 최선을 다할 것"이라고 했다.2025-08-08 09:00:12차지현 -
 최초의 RNAi 치료제 '기블라리'...국내 희귀약 지정차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ①기블라리기블라리(Givlaari®, giv-lah'-ree, 성분명: 기보시란, Givosiran, Alnylam)은 아미노레불린산 합성효소 1(aminolevulinate synthase 1, ALAS1)을 표적으로 하는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2019년 미국 FDA, 2020년 유럽 EMA에서 ‘급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)’ 치료제로 승인되었다. 국내에서는 2024년 GIFT(Global Innovative products on Fast Track)로 지정된 후, 희귀의약품으로 등록되었다.급성 간성 포르피린증(AHP)은 간에서 헴(heme) 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 독성 전구체인 포르피린이 축적되어 발생하는 매우 드문 질환이다. 환자는 심한 복통, 구토, 발작 등 쇠약하게 만드는 급성 증상뿐 아니라, 통증을 포함한 만성 증상도 동반할 수 있다.Heme은 산소 운반, 에너지 생성, 해독 대사, 산화 스트레스 조절 등 생명 유지에 필수적인 다양한 생리적 경로에 관여한다. 따라서 heme 생합성의 이상이나 전구체 공급의 장애, 또는 특정 조직에서의 heme 이용률 감소는 조직 산소 공급 저하로 이어져 피로, 운동 시 호흡곤란, 심계항진 등의 전신 증상을 유발한다. 또한 heme은 미토콘드리아 전자전달계의 핵심 구성 요소로 ATP 생성에 관여하므로, 결핍 시 에너지 대사 장애로 인해 신경세포 및 근육세포 기능 저하가 나타날 수 있다.기보시란은 GalNAc(GalNAc-conjugated delivery system)을 이용한 간세포 특이적 이중가닥 siRNA로, 간세포 내 ALAS1 mRNA를 선택적으로 분해함으로써 이 유전자 발현을 감소시킨다. 결과적으로 신경독성을 유발하는 중간대사산물인 아미노레불린산(ALA)과 포르포빌리노겐(PBG)의 혈중 농도가 낮아지고, 이는 AHP의 급성 발작 빈도와 증상 악화를 유발하는 병태생리적 기전을 억제하는 효과를 나타낸다.기보시란의 유효성은 다국가 무작위 이중맹검 위약대조 3상 임상시험인 ENVISION 연구를 통해 입증되었다. 이 연구에서 기보시란은 위약에 비해 연간 AHP 발작률을 74% 감소시켰으며, 이는 통계적으로 유의한 차이를 보였다. 해당 연구 결과는 2020년 6월 11일자 The New England Journal of Medicine(NEJM)에 게재되었다.6개월 치료 기간 동안 전혀 발작을 경험하지 않은 환자의 비율은 기보시란 치료군에서 50%, 위약군에서는 16.3%로 보고되어, 기보시란의 임상적 유용성을 뒷받침한다.급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 어떤 질환인가? 포르피리아(Porphyria)는 그리스어 porphura(보라색 염료)에서 유래한 명칭으로, 일부 환자의 소변이나 피부가 햇빛(자외선)에 노출될 때 붉거나 보라색으로 변색되는 현상에서 비롯되었다. 포르피리아는 헴(heme) 생합성 경로의 8단계 중 하나를 촉매하는 효소에 유전적 또는 후천적으로 이상이 생겨 발생하는 질환군을 말한다.각 효소에 결함이 생기면 해당 단계 이전의 전구체 물질이 체내에 축적되거나 소변 등을 통해 과도하게 배출되며, 이로 인해 다양한 임상 증상이 나타난다. 포르피리아의 유병률은 질환의 아형, 국가 및 지역에 따라 다양하게 보고된다.포르피리아는 간성(hepatic)과 조혈성(erythropoietic)으로 분류되며, 이 중 급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 간에서 헴 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 발생하는 드물고 만성적인 다기관 질환군이다. AHP는 다시 급성 간헐성 포르피린증(acute intermittent porphyria, AIP), 이형성 포르피린증(variegate porphyria, VP), 유전성 코프로포르피린증(hereditary coproporphyria, HCP), 델타-아미노레불린산 탈수소효소 결핍 포르피린증(delta-aminolevulinic acid dehydratase-deficiency porphyria, ALAD deficiency porphyria)으로 구분한다.이 중 AIP가 가장 흔한 형태로 보고된다. 각 아형은 간 내 특정 heme 생합성 효소의 기능적 결핍을 초래하며, 이로 인해 자유 heme의 간내 농도가 감소한다. 이에 대한 보상 작용으로 헴 생합성 경로의 속도 조절 효소인 ALA 합성효소 1(ALAS1)의 발현이 유도된다.그러나 ALAS1의 과발현은 독성 중간대사산물인 아미노레불린산(5-aminolevulinic acid, ALA)과 포르포빌리노겐(porphobilinogen, PBG)의 과도한 생성 및 축적을 초래한다. 이들 대사산물은 신경계, 간, 신장 등 여러 장기에 손상을 유발하는 병태생리학적 핵심 인자로 작용하며, 특히 ALA와 PBG는 강한 신경독성 물질로 알려져 있다. 이로 인해 AHP는 주로 신경학적 증상을 동반하는 급성 발작을 특징으로 한다.AHP의 진단은 임상적 의심에 기반하여 시행되는 생화학적 검사로 확립할 수 있으며, 특히 소변 내 PBG 농도가 정상 상한치의 3배 이상으로 상승한 경우 AHP를 강력히 시사한다. 이러한 수준의 PBG 상승은 AIP, VP, HCP에서만 관찰되며, 이는 AHP 진단의 특이성과 조기 인지에 중요한 근거가 된다.AHP는 임상적으로 급성 발작과 만성 증상이 혼재된 형태로 나타난다. 급성 발작은 심한 복통, 오심, 구토, 빈맥, 고혈압, 저나트륨혈증, 의식 변화, 근력 저하 등으로 나타나며, 치료가 지연될 경우 생명을 위협할 수 있다. 많은 환자들이 발작 간에도 지속적인 통증, 피로, 오심 등 만성 증상을 경험하며, 이는 삶의 질을 현저히 저하시킨다. 일부 환자는 반복되는 통증으로 인해 진통제, 특히 오피오이드(opioid)의 사용이 필요하게 되며, 이에 따른 약물 의존의 위험성 또한 고려되어야 한다.아미노레불린산 합성효소 1(5-Aminolevulinate synthase 1, ALAS1)는 무엇인가?아미노레불린산 합성효소 1(ALAS1)은 간을 비롯한 대부분의 비조혈성(non-erythroid) 조직에서 발현되는 heme 생합성 경로의 속도 조절(rate-limiting) 효소이다. ALAS1은 미토콘드리아 내에서 glycine과 succinyl-CoA를 기질로 사용하여 아미노레불린산(5-aminolevulinic acid, ALA)을 생성하며, 이는 heme 생합성의 첫 번째이자 핵심적인 반응이다.ALAS1의 발현은 간세포 내 자유 heme 농도에 의해 주로 음성 되먹임 조절(negative feedback regulation)을 받는다. 즉, 자유 heme이 충분할 경우 ALAS1의 전사(transcription)와 번역(translation)이 억제되며, 반대로 자유 heme이 고갈되면 ALAS1의 발현이 유도되어 heme 합성이 촉진된다. 이러한 조절 기전은 간세포의 대사 요구에 따른 heme 농도 유지에 필수적이다(Figure 1). Figure 1. Biosynthetic Pathway for the Synthesis of Heme 급성 간성 포르피린증(AHP)과 같은 질환에서는 heme 생합성 경로의 하위 효소 중 하나에 결함이 존재하여 heme의 생합성이 차단된다. 그 결과, 간 내 자유 heme 농도가 감소하고, 이에 대한 보상 기전으로 ALAS1의 발현이 과도하게 증가한다. 그러나 하위 효소의 기능 장애로 인해 생성된 ALA는 정상적으로 대사되지 못하고 축적되며, 이는 중추 및 말초 신경계에 독성을 유발하는 주된 병태생리적 원인으로 작용한다.따라서 ALAS1은 heme 생합성 경로의 대사 항상성 유지에 핵심적인 역할을 하며, 병리적인 상황에서는 질병의 발현과 직접적으로 연관되는 주요 분자 표적이 된다. 최근에는 ALAS1의 발현을 억제함으로써 ALA 및 포르포빌리노겐(PBG)의 축적을 방지하고 급성 발작을 예방하는 치료 전략이 개발되고 있으며, 이는 AHP 치료의 새로운 전기를 마련하고 있다.헴(Heme)은 어떤 물질인가?Heme은 철(Fe²& 8314;) 이온을 중심으로 하는 테트라피롤 고리 구조(tetrapyrrole ring structure)를 갖는 필수적인 생리적 보조인자로, 주로 헤모글로빈, 미오글로빈, 시토크롬, 카탈라아제 및 다양한 산화효소의 구성 성분으로 작용한다. 이러한 heme은 단순한 구조적 단백질 구성 요소 외에도 산소 운반, 전자 전달, 산화 환원 반응 및 약물 대사 등 광범위한 생물학적 반응에서 핵심적 역할을 수행한다.Heme의 생합성은 진핵세포에서 고도로 보존된 경로를 통해 이루어지며, 총 8단계의 효소 반응을 거친다. 이 과정은 glycine과 succinyl-CoA로부터 시작되며, 최초 반응은 미토콘드리아 내에서 ALA synthase(ALAS)에 의해 촉매된다.이후 생성된 5-aminolevulinic acid(ALA)는 세포질로 이동하여 일련의 효소 반응을 거친 후, 다시 미토콘드리아로 들어가 최종적으로 ferrochelatase에 의해 protoporphyrin IX에 철 이온이 삽입되면서 heme이 완성된다. 이처럼 heme 합성은 미토콘드리아와 세포질 사이를 오가는 복합적인 과정을 통해 정교하게 조절된다.생성된 heme은 조직에 따라 다양한 단백질 복합체에 삽입되어 기능을 수행한 후, 노화된 적혈구의 파괴 등을 통해 대식세포에 의해 분해된다. 이 과정에서 heme oxygenase는 heme을 biliverdin, 일산화탄소(CO), 자유 철 이온으로 분해하며, biliverdin은 biliverdin reductase에 의해 bilirubin으로 환원된다.비포합형 bilirubin은 간세포로 운반된 후 UDP-glucuronosyltransferase에 의해 포합형으로 전환되어 담즙을 통해 장관으로 배설된다. 장내에서는 포합형 bilirubin이 대사되어 stercobilin 및 urobilin 등의 색소로 전환되며 각각 대변 및 소변을 통해 배설된다.Heme 생합성과 대사 경로의 교란은 다양한 임상 질환과 밀접히 연관되어 있다. 예를 들어, 생합성 효소 중 특정 단계에 결함이 발생할 경우 전구체의 병적 축적이 일어나며, 이는 포르피리아와 같은 희귀 유전 대사 질환의 원인이 된다. 반면, 분해 단계의 이상은 고빌리루빈혈증 및 황달로 이어질 수 있으며, 이들 물질의 색 변화는 임상 진단에서 중요한 지표로 활용된다. 따라서 heme의 생합성부터 대사, 배설에 이르는 전 과정은 생리적 항상성과 병태생리 모두에서 중추적인 역할을 담당한다.기보시란은 어떤 약제인가?기보시란(Givosiran, 제품명: 기블라리, Givlaari)은 ALAS1을 표적으로 하는 소간섭 RNA(siRNA)이다. 이 약제는 간세포 내 ALAS1 mRNA를 선택적으로 분해하여 ALA 및 PBG의 생성을 억제함으로써 AHP의 급성 발작 빈도를 현저히 줄이는 것으로 나타났다.기보시란은 siRNA로 설계되어 있으며, N-아세틸갈락토사민(GalNAc) 접합체를 이용하여 간세포 특이적으로 전달된다. 이 기술은 Alnylam Pharmaceuticals의 플랫폼인 ESC(Enhanced Stabilization Chemistry) GalNAc-siRNA 기술에 기반하고 있다.AHP의 치료는 발작 시 hemin 정맥주사 또는 증상 완화에 초점을 두고 있었으나, 근본적인 기전을 직접적으로 조절하는 치료법은 부재하였다. 이러한 한계를 극복하기 위해 개발된 기보시란은 다기관 무작위 이중맹검 위약대조 임상시험인 ENVISION 연구에서는 기보시란 투여군에서 연간 발작 빈도가 위약군에 비해 약 74% 감소하였으며, 통증 감소 및 삶의 질 향상 등 유의한 임상적 개선이 보고되었다.따라서 기보시란은 RNAi 기술을 활용하여 간세포 내 병적 대사 경로를 조절하는 최초의 siRNA 기반 치료제로, 기존의 대증요법 중심 치료 패러다임을 넘어서는 질병 수정형(disease-modifying) 치료 전략이라고 할 수 있다.기보시란의 약리학적 기전은?ALAS1 염기 서열을 가진 합성 이중가닥 RNA(Synthetic double-stranded RNA with ALAS1 sequence)는 GalNAc와 결합하여 간세포에만 대부분 발현되는 galactose 수용체의 일종인 ASGPR(asialoglycoprotein receptor)를 표적으로 결합하여 약물이 선택적으로 간세포에 도달하도록 하며, 간세포 내로 진입한 siRNA는 세포 내 효소인 다이서(Dicer)에 의해 약 20 염기쌍(bp) 조각으로 처리된 후 단일 가닥으로 분리된다.ALAS1에 상보적인 가닥(가이드 가닥)은 세포 내 ALAS1 mRNA에 결합하고 RNA 유도 침묵 복합체(RISC)에 탑재된다. 이후 가이드 가닥은 ALAS1 mRNA와 염기서열 상 완전한 상보성을 이루어 결합하며, 해당 mRNA는 절단되어 분해된다. 그 결과, ALA1 단백질의 수치가 감소하고 ALA의 생성이 줄어들면서 단백질 번역을 차단된다(Figure 1). Figure 2. The Mechanism of small interfering RNA(siRNA) Therapy(출처: Drug Design, Development and Therapy 2022:16) 기보시란은 간에 대한 높은 특이성을 가지기 때문에, 약동학 및 흡수, 분포, 대사, 배설(ADME) 프로파일이 쥐 실험에서 모두 우수하게 나타났다. 해당 약동학 연구에 따르면 기보시란의 간 내 농도는 신장보다 11배 높게 나타났다. 기보시란은 심장, 폐, 부신 등 여러 장기에서도 발견되었으나, 간에서의 농도보다 훨씬 낮은 수준으로 검출되었다. 뇌에서는 기보시란이 검출되지 않았으며, 분해된 RNA 조각은 소변으로 배출되었다.기보시란의 투여 용량에 따라 혈청 내 ALAS1 mRNA 및 소변 내 δ-ALA, PBG 수치가 빠르고 지속적으로, 그리고 용량 의존적으로 감소했다.ASGPR 수용체가 말초 단핵세포, 복막 대식세포, 자궁내막 세포, 신장 세뇨관 세포 등에서도 발현되기는 하지만, 기보시란은 간에 대한 선택적 표적성을 보여 오프 타깃 효과 가능성이 낮다.하지만 신장에서의 일부 축적 가능성과 관련하여, 임상시험 및 최근 연구에서는 기보시란 사용 시 혈청 크레아티닌(Cr) 상승과 추정 사구체 여과율(eGFR) 감소가 보고된 바 있으며, 장기적인 신장 기능에 대한 부작용 가능성을 완전히 배제할 수는 없다.기보시란(GIVLAARI)의 허가 임상 결과는 어떠한가?기보시란의 급성 간성 포르피린증(AHP) 환자에 대한 유효성은 무작위배정, 이중눈가림, 위약대조, 다국가 임상시험인 ENVISION 연구를 통해 평가되었다.ENVISION 연구에는 총 94명의 AHP 환자가 등록되었으며, 이 중 89명은 급성 간성 포르피린증(AIP), 2명은 다형 포르피린증(VP), 1명은 유전성 코프로포르피린증(HCP), 2명은 유전자 변이가 확인되지 않은 환자였다. 이들 94명 중 48명은 GIVLAARI군, 46명은 위약군으로 무작위 배정되었다.해당 환자들은 등록 전 6개월 동안 입원, 응급 진료 방문, 또는 가정에서의 정맥주사용 hemin 투여가 필요한 포르피린 발작을 최소 2회 경험한 경우에만 포함되었으며, 이들을 대상으로 GIVLAARI 2.5mg/kg 또는 위약을 월 1회 피하주사하는 방식으로 1:1 무작위 배정하여 6개월간 치료하였다.6개월의 이중눈가림 기간이 종료된 후, 93명의 환자가 최대 30개월 동안의 공개연장(open-label extension) 연구에 등록되었다. 연구 기간 중 포르피린 급성 발작의 치료를 위한 hemin 사용은 허용되었다.연구 대상 환자의 중앙 연령은 37.5세(범위: 19~65세)였으며, 89%는 여성, 78%는 백인이었다. GIVLAARI군과 위약군은 포르피린 발작의 과거 발생 빈도, 이전 hemin 예방요법 사용 여부, 아편유사제(opioid) 복용 여부, 발작 사이 통증에 대한 환자 보고 척도 등에서 유사한 특성을 보였다.주요 평가 지표는 AHP의 가장 흔한 아형인 AIP 환자에서의 연간 환산 복합 포르피린 발작률이었다. 복합 포르피린 발작은 입원, 응급 의료기관 방문, 또는 자가 투여한 정맥 내 hemin 투여로 정의되었다.주요 이차 평가 지표는 ALA 및 PBG 수치, 전체 AHP 환자의 연간 발작률, 그리고 급성 간헐성 포르피린증 환자에서의 헴 사용량 및 하루 중 가장 심한 통증 점수였다.AIP 환자에서 6개월 동안의 연간 환산 복합 포르피린 발작률은 GIVLAARI군에서 평균 3.2회(95% CI, 2.3-4.6), 위약군에서 평균 12.5회(95% CI, 9.4-16.8)로, GIVLAARI군에서 74% 낮은 발작률을 보였다.AIP 환자들 중에서, GIVLAARI 투여는 요중 ALA 및 PBG 수치 감소, hemin 사용 일수 감소, 그리고 하루 중 가장 심한 통증 점수 개선에 있어 위약보다 더 우수한 효과를 보였다.GIVLAARI군에서 더 자주 나타난 주요 이상 반응으로는 혈청 아미노트랜스퍼레이스 수치 상승, 혈청 크레아티닌 수치 및 추정 사구체여과율(eGFR)의 변화, 그리고 주사 부위 반응이 있었다.기보시란의 예상되는 쟁점은 무엇인가?기보시란은 GalNAc-siRNA 플랫폼을 활용하여 간세포 특이적으로 작용함으로써 높은 치료 효율성을 나타내며, 간세포 표면의 ASGPR 수용체를 이용한 특이적 전달을 통해 오프타깃(off-target) 효과를 최소화하였다. 피하 주사로 월 1회 투여가 가능하며, 실제 임상시험에서 발작 빈도 감소, 통증 완화, 삶의 질 향상 등 유의미한 임상 혜택이 입증되었다.대표적인 pivotal study인 ENVISION 임상시험은 기보시란의 임상적 유효성과 안전성을 입증하며 미국 FDA 및 EMA의 승인을 획득하는 데 기여하였다. 그러나 ENVISION 연구는 치료 효과와 관련하여 여러 측면에서 제한점이 존재함이 보고되고 있으며, 이는 실제 임상 적용 및 후속 연구 설계에 있어 중요한 고려사항이 된다.첫째, 연구에 포함된 환자 수가 94명으로 제한적이며, 이 중 대부분이 AIP(acute intermittent porphyria) 환자로 구성되어 AHP 전체 스펙트럼에 대한 일반화에 제약이 있다.둘째, 이중눈가림 기간은 6개월로 설정되어 있어 장기적 효능 지속성과 안전성 평가에는 부족한 측면이 있다. 특히 연장 연구는 비통제 환경에서 수행되었기에 객관적 유효성 판단에 한계가 있다.또한 기보시란은 대부분 여성(89%)에게 투여되었기 때문에 성별 간 반응 차이를 평가하기 어렵고, 주요 평가 변수가 급성 발작 빈도 감소에 집중되어 있어 삶의 질, 통증 완화, 기능 회복 등 임상적으로 중요한 지표들은 충분히 반영되지 못하였다. 더불어 일부 환자에서 간 효소 상승, 신기능 변화, 피로 등의 이상반응이 관찰되었으며, 장기간 투여에 따른 누적 독성 가능성은 추후 연구가 요구된다.뿐만 아니라, 고가의 희귀질환 치료제로서 경제성 평가 역시 중요한 쟁점으로 대두되고 있으며, 특히 발작 빈도가 낮은 환자군에서는 비용 대비 임상적 이득이 불분명하다는 지적이 제기되고 있다.따라서 기보시란은 RNAi 기반 정기 투여 치료제 중 최초로 승인된 사례로, RNAi 기술의 상업화 가능성을 입증한 전례로도 의의가 깊다. 나아가 희귀 유전질환을 대상으로 한 차세대 치료제 개발의 가능성을 제시함과 동시에, 간 특이적 전달 기술의 실제 적용 가능성 또한 입증하였다. 또한 AHP 환자에게 새로운 치료 옵션을 제공할 것으로 기대된다.참고문헌 1. Lei Zhang et al. “The therapeutic prospects of N-acetylgalactosamine-siRNA conjugates“ Front. Pharmacol., 14 December 2022. 2 Chaudry Nasir Majeed et al. “Spotlight on Givosiran as a Treatment Option for Adults with Acute Hepatic Porphyria: Design, Development, and Place in Therapy” Drug Design,Developmentand Therapy 2022:16. 3. M. Balwani et al. “Phase 3 Trial of RNAi Therapeutic Givosiran for Acute Intermittent Porphyria” N Engl J Med 2020;382:2289-301. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-08 06:10:01최병철 박사
최초의 RNAi 치료제 '기블라리'...국내 희귀약 지정차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ①기블라리기블라리(Givlaari®, giv-lah'-ree, 성분명: 기보시란, Givosiran, Alnylam)은 아미노레불린산 합성효소 1(aminolevulinate synthase 1, ALAS1)을 표적으로 하는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2019년 미국 FDA, 2020년 유럽 EMA에서 ‘급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)’ 치료제로 승인되었다. 국내에서는 2024년 GIFT(Global Innovative products on Fast Track)로 지정된 후, 희귀의약품으로 등록되었다.급성 간성 포르피린증(AHP)은 간에서 헴(heme) 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 독성 전구체인 포르피린이 축적되어 발생하는 매우 드문 질환이다. 환자는 심한 복통, 구토, 발작 등 쇠약하게 만드는 급성 증상뿐 아니라, 통증을 포함한 만성 증상도 동반할 수 있다.Heme은 산소 운반, 에너지 생성, 해독 대사, 산화 스트레스 조절 등 생명 유지에 필수적인 다양한 생리적 경로에 관여한다. 따라서 heme 생합성의 이상이나 전구체 공급의 장애, 또는 특정 조직에서의 heme 이용률 감소는 조직 산소 공급 저하로 이어져 피로, 운동 시 호흡곤란, 심계항진 등의 전신 증상을 유발한다. 또한 heme은 미토콘드리아 전자전달계의 핵심 구성 요소로 ATP 생성에 관여하므로, 결핍 시 에너지 대사 장애로 인해 신경세포 및 근육세포 기능 저하가 나타날 수 있다.기보시란은 GalNAc(GalNAc-conjugated delivery system)을 이용한 간세포 특이적 이중가닥 siRNA로, 간세포 내 ALAS1 mRNA를 선택적으로 분해함으로써 이 유전자 발현을 감소시킨다. 결과적으로 신경독성을 유발하는 중간대사산물인 아미노레불린산(ALA)과 포르포빌리노겐(PBG)의 혈중 농도가 낮아지고, 이는 AHP의 급성 발작 빈도와 증상 악화를 유발하는 병태생리적 기전을 억제하는 효과를 나타낸다.기보시란의 유효성은 다국가 무작위 이중맹검 위약대조 3상 임상시험인 ENVISION 연구를 통해 입증되었다. 이 연구에서 기보시란은 위약에 비해 연간 AHP 발작률을 74% 감소시켰으며, 이는 통계적으로 유의한 차이를 보였다. 해당 연구 결과는 2020년 6월 11일자 The New England Journal of Medicine(NEJM)에 게재되었다.6개월 치료 기간 동안 전혀 발작을 경험하지 않은 환자의 비율은 기보시란 치료군에서 50%, 위약군에서는 16.3%로 보고되어, 기보시란의 임상적 유용성을 뒷받침한다.급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 어떤 질환인가? 포르피리아(Porphyria)는 그리스어 porphura(보라색 염료)에서 유래한 명칭으로, 일부 환자의 소변이나 피부가 햇빛(자외선)에 노출될 때 붉거나 보라색으로 변색되는 현상에서 비롯되었다. 포르피리아는 헴(heme) 생합성 경로의 8단계 중 하나를 촉매하는 효소에 유전적 또는 후천적으로 이상이 생겨 발생하는 질환군을 말한다.각 효소에 결함이 생기면 해당 단계 이전의 전구체 물질이 체내에 축적되거나 소변 등을 통해 과도하게 배출되며, 이로 인해 다양한 임상 증상이 나타난다. 포르피리아의 유병률은 질환의 아형, 국가 및 지역에 따라 다양하게 보고된다.포르피리아는 간성(hepatic)과 조혈성(erythropoietic)으로 분류되며, 이 중 급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 간에서 헴 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 발생하는 드물고 만성적인 다기관 질환군이다. AHP는 다시 급성 간헐성 포르피린증(acute intermittent porphyria, AIP), 이형성 포르피린증(variegate porphyria, VP), 유전성 코프로포르피린증(hereditary coproporphyria, HCP), 델타-아미노레불린산 탈수소효소 결핍 포르피린증(delta-aminolevulinic acid dehydratase-deficiency porphyria, ALAD deficiency porphyria)으로 구분한다.이 중 AIP가 가장 흔한 형태로 보고된다. 각 아형은 간 내 특정 heme 생합성 효소의 기능적 결핍을 초래하며, 이로 인해 자유 heme의 간내 농도가 감소한다. 이에 대한 보상 작용으로 헴 생합성 경로의 속도 조절 효소인 ALA 합성효소 1(ALAS1)의 발현이 유도된다.그러나 ALAS1의 과발현은 독성 중간대사산물인 아미노레불린산(5-aminolevulinic acid, ALA)과 포르포빌리노겐(porphobilinogen, PBG)의 과도한 생성 및 축적을 초래한다. 이들 대사산물은 신경계, 간, 신장 등 여러 장기에 손상을 유발하는 병태생리학적 핵심 인자로 작용하며, 특히 ALA와 PBG는 강한 신경독성 물질로 알려져 있다. 이로 인해 AHP는 주로 신경학적 증상을 동반하는 급성 발작을 특징으로 한다.AHP의 진단은 임상적 의심에 기반하여 시행되는 생화학적 검사로 확립할 수 있으며, 특히 소변 내 PBG 농도가 정상 상한치의 3배 이상으로 상승한 경우 AHP를 강력히 시사한다. 이러한 수준의 PBG 상승은 AIP, VP, HCP에서만 관찰되며, 이는 AHP 진단의 특이성과 조기 인지에 중요한 근거가 된다.AHP는 임상적으로 급성 발작과 만성 증상이 혼재된 형태로 나타난다. 급성 발작은 심한 복통, 오심, 구토, 빈맥, 고혈압, 저나트륨혈증, 의식 변화, 근력 저하 등으로 나타나며, 치료가 지연될 경우 생명을 위협할 수 있다. 많은 환자들이 발작 간에도 지속적인 통증, 피로, 오심 등 만성 증상을 경험하며, 이는 삶의 질을 현저히 저하시킨다. 일부 환자는 반복되는 통증으로 인해 진통제, 특히 오피오이드(opioid)의 사용이 필요하게 되며, 이에 따른 약물 의존의 위험성 또한 고려되어야 한다.아미노레불린산 합성효소 1(5-Aminolevulinate synthase 1, ALAS1)는 무엇인가?아미노레불린산 합성효소 1(ALAS1)은 간을 비롯한 대부분의 비조혈성(non-erythroid) 조직에서 발현되는 heme 생합성 경로의 속도 조절(rate-limiting) 효소이다. ALAS1은 미토콘드리아 내에서 glycine과 succinyl-CoA를 기질로 사용하여 아미노레불린산(5-aminolevulinic acid, ALA)을 생성하며, 이는 heme 생합성의 첫 번째이자 핵심적인 반응이다.ALAS1의 발현은 간세포 내 자유 heme 농도에 의해 주로 음성 되먹임 조절(negative feedback regulation)을 받는다. 즉, 자유 heme이 충분할 경우 ALAS1의 전사(transcription)와 번역(translation)이 억제되며, 반대로 자유 heme이 고갈되면 ALAS1의 발현이 유도되어 heme 합성이 촉진된다. 이러한 조절 기전은 간세포의 대사 요구에 따른 heme 농도 유지에 필수적이다(Figure 1). Figure 1. Biosynthetic Pathway for the Synthesis of Heme 급성 간성 포르피린증(AHP)과 같은 질환에서는 heme 생합성 경로의 하위 효소 중 하나에 결함이 존재하여 heme의 생합성이 차단된다. 그 결과, 간 내 자유 heme 농도가 감소하고, 이에 대한 보상 기전으로 ALAS1의 발현이 과도하게 증가한다. 그러나 하위 효소의 기능 장애로 인해 생성된 ALA는 정상적으로 대사되지 못하고 축적되며, 이는 중추 및 말초 신경계에 독성을 유발하는 주된 병태생리적 원인으로 작용한다.따라서 ALAS1은 heme 생합성 경로의 대사 항상성 유지에 핵심적인 역할을 하며, 병리적인 상황에서는 질병의 발현과 직접적으로 연관되는 주요 분자 표적이 된다. 최근에는 ALAS1의 발현을 억제함으로써 ALA 및 포르포빌리노겐(PBG)의 축적을 방지하고 급성 발작을 예방하는 치료 전략이 개발되고 있으며, 이는 AHP 치료의 새로운 전기를 마련하고 있다.헴(Heme)은 어떤 물질인가?Heme은 철(Fe²& 8314;) 이온을 중심으로 하는 테트라피롤 고리 구조(tetrapyrrole ring structure)를 갖는 필수적인 생리적 보조인자로, 주로 헤모글로빈, 미오글로빈, 시토크롬, 카탈라아제 및 다양한 산화효소의 구성 성분으로 작용한다. 이러한 heme은 단순한 구조적 단백질 구성 요소 외에도 산소 운반, 전자 전달, 산화 환원 반응 및 약물 대사 등 광범위한 생물학적 반응에서 핵심적 역할을 수행한다.Heme의 생합성은 진핵세포에서 고도로 보존된 경로를 통해 이루어지며, 총 8단계의 효소 반응을 거친다. 이 과정은 glycine과 succinyl-CoA로부터 시작되며, 최초 반응은 미토콘드리아 내에서 ALA synthase(ALAS)에 의해 촉매된다.이후 생성된 5-aminolevulinic acid(ALA)는 세포질로 이동하여 일련의 효소 반응을 거친 후, 다시 미토콘드리아로 들어가 최종적으로 ferrochelatase에 의해 protoporphyrin IX에 철 이온이 삽입되면서 heme이 완성된다. 이처럼 heme 합성은 미토콘드리아와 세포질 사이를 오가는 복합적인 과정을 통해 정교하게 조절된다.생성된 heme은 조직에 따라 다양한 단백질 복합체에 삽입되어 기능을 수행한 후, 노화된 적혈구의 파괴 등을 통해 대식세포에 의해 분해된다. 이 과정에서 heme oxygenase는 heme을 biliverdin, 일산화탄소(CO), 자유 철 이온으로 분해하며, biliverdin은 biliverdin reductase에 의해 bilirubin으로 환원된다.비포합형 bilirubin은 간세포로 운반된 후 UDP-glucuronosyltransferase에 의해 포합형으로 전환되어 담즙을 통해 장관으로 배설된다. 장내에서는 포합형 bilirubin이 대사되어 stercobilin 및 urobilin 등의 색소로 전환되며 각각 대변 및 소변을 통해 배설된다.Heme 생합성과 대사 경로의 교란은 다양한 임상 질환과 밀접히 연관되어 있다. 예를 들어, 생합성 효소 중 특정 단계에 결함이 발생할 경우 전구체의 병적 축적이 일어나며, 이는 포르피리아와 같은 희귀 유전 대사 질환의 원인이 된다. 반면, 분해 단계의 이상은 고빌리루빈혈증 및 황달로 이어질 수 있으며, 이들 물질의 색 변화는 임상 진단에서 중요한 지표로 활용된다. 따라서 heme의 생합성부터 대사, 배설에 이르는 전 과정은 생리적 항상성과 병태생리 모두에서 중추적인 역할을 담당한다.기보시란은 어떤 약제인가?기보시란(Givosiran, 제품명: 기블라리, Givlaari)은 ALAS1을 표적으로 하는 소간섭 RNA(siRNA)이다. 이 약제는 간세포 내 ALAS1 mRNA를 선택적으로 분해하여 ALA 및 PBG의 생성을 억제함으로써 AHP의 급성 발작 빈도를 현저히 줄이는 것으로 나타났다.기보시란은 siRNA로 설계되어 있으며, N-아세틸갈락토사민(GalNAc) 접합체를 이용하여 간세포 특이적으로 전달된다. 이 기술은 Alnylam Pharmaceuticals의 플랫폼인 ESC(Enhanced Stabilization Chemistry) GalNAc-siRNA 기술에 기반하고 있다.AHP의 치료는 발작 시 hemin 정맥주사 또는 증상 완화에 초점을 두고 있었으나, 근본적인 기전을 직접적으로 조절하는 치료법은 부재하였다. 이러한 한계를 극복하기 위해 개발된 기보시란은 다기관 무작위 이중맹검 위약대조 임상시험인 ENVISION 연구에서는 기보시란 투여군에서 연간 발작 빈도가 위약군에 비해 약 74% 감소하였으며, 통증 감소 및 삶의 질 향상 등 유의한 임상적 개선이 보고되었다.따라서 기보시란은 RNAi 기술을 활용하여 간세포 내 병적 대사 경로를 조절하는 최초의 siRNA 기반 치료제로, 기존의 대증요법 중심 치료 패러다임을 넘어서는 질병 수정형(disease-modifying) 치료 전략이라고 할 수 있다.기보시란의 약리학적 기전은?ALAS1 염기 서열을 가진 합성 이중가닥 RNA(Synthetic double-stranded RNA with ALAS1 sequence)는 GalNAc와 결합하여 간세포에만 대부분 발현되는 galactose 수용체의 일종인 ASGPR(asialoglycoprotein receptor)를 표적으로 결합하여 약물이 선택적으로 간세포에 도달하도록 하며, 간세포 내로 진입한 siRNA는 세포 내 효소인 다이서(Dicer)에 의해 약 20 염기쌍(bp) 조각으로 처리된 후 단일 가닥으로 분리된다.ALAS1에 상보적인 가닥(가이드 가닥)은 세포 내 ALAS1 mRNA에 결합하고 RNA 유도 침묵 복합체(RISC)에 탑재된다. 이후 가이드 가닥은 ALAS1 mRNA와 염기서열 상 완전한 상보성을 이루어 결합하며, 해당 mRNA는 절단되어 분해된다. 그 결과, ALA1 단백질의 수치가 감소하고 ALA의 생성이 줄어들면서 단백질 번역을 차단된다(Figure 1). Figure 2. The Mechanism of small interfering RNA(siRNA) Therapy(출처: Drug Design, Development and Therapy 2022:16) 기보시란은 간에 대한 높은 특이성을 가지기 때문에, 약동학 및 흡수, 분포, 대사, 배설(ADME) 프로파일이 쥐 실험에서 모두 우수하게 나타났다. 해당 약동학 연구에 따르면 기보시란의 간 내 농도는 신장보다 11배 높게 나타났다. 기보시란은 심장, 폐, 부신 등 여러 장기에서도 발견되었으나, 간에서의 농도보다 훨씬 낮은 수준으로 검출되었다. 뇌에서는 기보시란이 검출되지 않았으며, 분해된 RNA 조각은 소변으로 배출되었다.기보시란의 투여 용량에 따라 혈청 내 ALAS1 mRNA 및 소변 내 δ-ALA, PBG 수치가 빠르고 지속적으로, 그리고 용량 의존적으로 감소했다.ASGPR 수용체가 말초 단핵세포, 복막 대식세포, 자궁내막 세포, 신장 세뇨관 세포 등에서도 발현되기는 하지만, 기보시란은 간에 대한 선택적 표적성을 보여 오프 타깃 효과 가능성이 낮다.하지만 신장에서의 일부 축적 가능성과 관련하여, 임상시험 및 최근 연구에서는 기보시란 사용 시 혈청 크레아티닌(Cr) 상승과 추정 사구체 여과율(eGFR) 감소가 보고된 바 있으며, 장기적인 신장 기능에 대한 부작용 가능성을 완전히 배제할 수는 없다.기보시란(GIVLAARI)의 허가 임상 결과는 어떠한가?기보시란의 급성 간성 포르피린증(AHP) 환자에 대한 유효성은 무작위배정, 이중눈가림, 위약대조, 다국가 임상시험인 ENVISION 연구를 통해 평가되었다.ENVISION 연구에는 총 94명의 AHP 환자가 등록되었으며, 이 중 89명은 급성 간성 포르피린증(AIP), 2명은 다형 포르피린증(VP), 1명은 유전성 코프로포르피린증(HCP), 2명은 유전자 변이가 확인되지 않은 환자였다. 이들 94명 중 48명은 GIVLAARI군, 46명은 위약군으로 무작위 배정되었다.해당 환자들은 등록 전 6개월 동안 입원, 응급 진료 방문, 또는 가정에서의 정맥주사용 hemin 투여가 필요한 포르피린 발작을 최소 2회 경험한 경우에만 포함되었으며, 이들을 대상으로 GIVLAARI 2.5mg/kg 또는 위약을 월 1회 피하주사하는 방식으로 1:1 무작위 배정하여 6개월간 치료하였다.6개월의 이중눈가림 기간이 종료된 후, 93명의 환자가 최대 30개월 동안의 공개연장(open-label extension) 연구에 등록되었다. 연구 기간 중 포르피린 급성 발작의 치료를 위한 hemin 사용은 허용되었다.연구 대상 환자의 중앙 연령은 37.5세(범위: 19~65세)였으며, 89%는 여성, 78%는 백인이었다. GIVLAARI군과 위약군은 포르피린 발작의 과거 발생 빈도, 이전 hemin 예방요법 사용 여부, 아편유사제(opioid) 복용 여부, 발작 사이 통증에 대한 환자 보고 척도 등에서 유사한 특성을 보였다.주요 평가 지표는 AHP의 가장 흔한 아형인 AIP 환자에서의 연간 환산 복합 포르피린 발작률이었다. 복합 포르피린 발작은 입원, 응급 의료기관 방문, 또는 자가 투여한 정맥 내 hemin 투여로 정의되었다.주요 이차 평가 지표는 ALA 및 PBG 수치, 전체 AHP 환자의 연간 발작률, 그리고 급성 간헐성 포르피린증 환자에서의 헴 사용량 및 하루 중 가장 심한 통증 점수였다.AIP 환자에서 6개월 동안의 연간 환산 복합 포르피린 발작률은 GIVLAARI군에서 평균 3.2회(95% CI, 2.3-4.6), 위약군에서 평균 12.5회(95% CI, 9.4-16.8)로, GIVLAARI군에서 74% 낮은 발작률을 보였다.AIP 환자들 중에서, GIVLAARI 투여는 요중 ALA 및 PBG 수치 감소, hemin 사용 일수 감소, 그리고 하루 중 가장 심한 통증 점수 개선에 있어 위약보다 더 우수한 효과를 보였다.GIVLAARI군에서 더 자주 나타난 주요 이상 반응으로는 혈청 아미노트랜스퍼레이스 수치 상승, 혈청 크레아티닌 수치 및 추정 사구체여과율(eGFR)의 변화, 그리고 주사 부위 반응이 있었다.기보시란의 예상되는 쟁점은 무엇인가?기보시란은 GalNAc-siRNA 플랫폼을 활용하여 간세포 특이적으로 작용함으로써 높은 치료 효율성을 나타내며, 간세포 표면의 ASGPR 수용체를 이용한 특이적 전달을 통해 오프타깃(off-target) 효과를 최소화하였다. 피하 주사로 월 1회 투여가 가능하며, 실제 임상시험에서 발작 빈도 감소, 통증 완화, 삶의 질 향상 등 유의미한 임상 혜택이 입증되었다.대표적인 pivotal study인 ENVISION 임상시험은 기보시란의 임상적 유효성과 안전성을 입증하며 미국 FDA 및 EMA의 승인을 획득하는 데 기여하였다. 그러나 ENVISION 연구는 치료 효과와 관련하여 여러 측면에서 제한점이 존재함이 보고되고 있으며, 이는 실제 임상 적용 및 후속 연구 설계에 있어 중요한 고려사항이 된다.첫째, 연구에 포함된 환자 수가 94명으로 제한적이며, 이 중 대부분이 AIP(acute intermittent porphyria) 환자로 구성되어 AHP 전체 스펙트럼에 대한 일반화에 제약이 있다.둘째, 이중눈가림 기간은 6개월로 설정되어 있어 장기적 효능 지속성과 안전성 평가에는 부족한 측면이 있다. 특히 연장 연구는 비통제 환경에서 수행되었기에 객관적 유효성 판단에 한계가 있다.또한 기보시란은 대부분 여성(89%)에게 투여되었기 때문에 성별 간 반응 차이를 평가하기 어렵고, 주요 평가 변수가 급성 발작 빈도 감소에 집중되어 있어 삶의 질, 통증 완화, 기능 회복 등 임상적으로 중요한 지표들은 충분히 반영되지 못하였다. 더불어 일부 환자에서 간 효소 상승, 신기능 변화, 피로 등의 이상반응이 관찰되었으며, 장기간 투여에 따른 누적 독성 가능성은 추후 연구가 요구된다.뿐만 아니라, 고가의 희귀질환 치료제로서 경제성 평가 역시 중요한 쟁점으로 대두되고 있으며, 특히 발작 빈도가 낮은 환자군에서는 비용 대비 임상적 이득이 불분명하다는 지적이 제기되고 있다.따라서 기보시란은 RNAi 기반 정기 투여 치료제 중 최초로 승인된 사례로, RNAi 기술의 상업화 가능성을 입증한 전례로도 의의가 깊다. 나아가 희귀 유전질환을 대상으로 한 차세대 치료제 개발의 가능성을 제시함과 동시에, 간 특이적 전달 기술의 실제 적용 가능성 또한 입증하였다. 또한 AHP 환자에게 새로운 치료 옵션을 제공할 것으로 기대된다.참고문헌 1. Lei Zhang et al. “The therapeutic prospects of N-acetylgalactosamine-siRNA conjugates“ Front. Pharmacol., 14 December 2022. 2 Chaudry Nasir Majeed et al. “Spotlight on Givosiran as a Treatment Option for Adults with Acute Hepatic Porphyria: Design, Development, and Place in Therapy” Drug Design,Developmentand Therapy 2022:16. 3. M. Balwani et al. “Phase 3 Trial of RNAi Therapeutic Givosiran for Acute Intermittent Porphyria” N Engl J Med 2020;382:2289-301. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-08 06:10:01최병철 박사 -
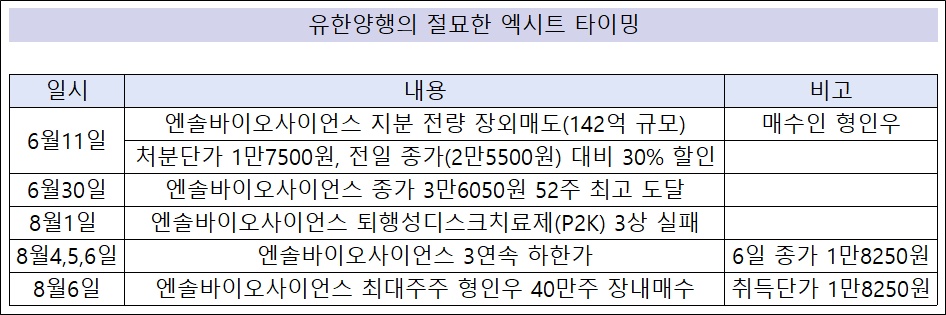 3상 실패 직전 엑시트…유한양행 절묘한 손절 타이밍[데일리팜=이석준 기자] 유한양행의 절묘한 손절 타이밍이 재조명되고 있다. 유한양행은 투자 기업의 신약후보물질 3상 실패 직전 엑시트(투자금 회수)를 단행했다.당시 보유 주식 전량 처분 단가가 전일 종가 대비 30% 낮아 의구심을 자아냈다. 다만 두달후 해당 기업 주가가 3상 실패로 급락하면서 유한양행의 엑시트 전략이 적중했다는 평가를 받는다. 코넥스 엔솔바이오사이언스는 사흘 연속 하한가를 맞았다. 이에 종가 기준 8월 1일 2만9600원이던 주가는 6일 1만8250원까지 떨어졌다. 코넥스 시장 가격 하한폭은 -15%다. 7일 장중 한때 1만5520원까지 내려갔다.3상 실패 때문이다. 지난 1일 퇴행성 디스크 치료제 P2K의 미국 3상 결과가 1차 평가 지표를 충족하지 못한 것으로 발표됐다. P2K는 엔솔바이오사이언스가 개발하고 있는 신약 중 가장 상용화에 근접한 것으로 평가됐다. 이에 주가는 급락했다.엔솔바이오사이언스는 2009년 P2K 개발 권리를 유한양행에 기술 이전했다. 유한양행은 자체 2상을 거쳐 해당 물질을 2018년 스파인바이오파마에 다시 이전했다. 이후 스파인바이오파마가 3상을 진행했다.유한양행은 P2K를 기술이전했지만 엔솔바이오사이언스 주식은 쥐고 있었다. 다만 지난 6월 11일 돌연 엔솔바이오사이언스 주식 전량을 처분했다. 당시 현 엔솔바이오사이언스 최대주주 형인우씨가 유한양행 물량을 전량 받아갔다. 형인우씨는 '알테오젠' 투자 대박으로 유명한 인물이다.유한양행은 2011년 엔솔바이오사이언스 주식 취득 이후 14년 만에 모두 처분하며 127억원의 수익을 냈다. 다만 처분 단가가 1만7500원이어서 의구심을 자아냈다. 이는 전일 종가(2만5500원)보다 30% 가량 낮은 수치였다. 유한양행은 임상 실패에, 형인우씨는 성공에 베팅했다는 해석이 나왔다.이후 엔솔바이오사이언스 주가는 6월 30일 3만6050원까지 치솟았다. 유한양행의 처분단가(1만7500원)보다 2배 이상 올랐다. 불과 20여일 만이다. 이에 유한양행의 손절 타이밍이 빨랐다는 의견이 나왔다.다만 8월 11일 P2K 3상 실패 소식이 전해지며 결과적으로 유한양행의 엔솔바이오사이언스 전량 엑시트는 성공적이었다는 평가를 받게 됐다.잇단 엑시트 '오픈이노베이션 전략유한양행은 엔솔바이오사이언스 외에도 바이오벤처 엑시트에 나서고 있다. 지난해만 봐도 워랜텍, 제넥신, 에이프릴바이오 지분을 전량 처분했다.타법인 지분 매도는 올해도 이어지고 있다.유한양행은 5월 28일부터 6월 20일까지 지아이이노베이션의 주식 총 108만3417주를 매도했다. 총 처분 금액은 204억원이다. 남은 주식 수는 108만3418주, 지분율은 1.7%로 떨어졌다.이번에 매도한 주식은 대부분 시리즈B 물량으로 파악된다. 시리즈B 투자금 60억원을 고려하면 이번 지분매도로 유한양행이 벌어들인 수익은 약 140억원에 달할 것으로 추정된다. 대략 240% 수익률이다.업계 관계자는 "유한양행이 과거 투자한 바이오 기업의 포트폴리오를 정리하는 모습이다. 타법인 투자에 집중하던 오픈이노베이션 전략이 변화하고 있다"고 분석했다.2025-08-08 06:00:39이석준
3상 실패 직전 엑시트…유한양행 절묘한 손절 타이밍[데일리팜=이석준 기자] 유한양행의 절묘한 손절 타이밍이 재조명되고 있다. 유한양행은 투자 기업의 신약후보물질 3상 실패 직전 엑시트(투자금 회수)를 단행했다.당시 보유 주식 전량 처분 단가가 전일 종가 대비 30% 낮아 의구심을 자아냈다. 다만 두달후 해당 기업 주가가 3상 실패로 급락하면서 유한양행의 엑시트 전략이 적중했다는 평가를 받는다. 코넥스 엔솔바이오사이언스는 사흘 연속 하한가를 맞았다. 이에 종가 기준 8월 1일 2만9600원이던 주가는 6일 1만8250원까지 떨어졌다. 코넥스 시장 가격 하한폭은 -15%다. 7일 장중 한때 1만5520원까지 내려갔다.3상 실패 때문이다. 지난 1일 퇴행성 디스크 치료제 P2K의 미국 3상 결과가 1차 평가 지표를 충족하지 못한 것으로 발표됐다. P2K는 엔솔바이오사이언스가 개발하고 있는 신약 중 가장 상용화에 근접한 것으로 평가됐다. 이에 주가는 급락했다.엔솔바이오사이언스는 2009년 P2K 개발 권리를 유한양행에 기술 이전했다. 유한양행은 자체 2상을 거쳐 해당 물질을 2018년 스파인바이오파마에 다시 이전했다. 이후 스파인바이오파마가 3상을 진행했다.유한양행은 P2K를 기술이전했지만 엔솔바이오사이언스 주식은 쥐고 있었다. 다만 지난 6월 11일 돌연 엔솔바이오사이언스 주식 전량을 처분했다. 당시 현 엔솔바이오사이언스 최대주주 형인우씨가 유한양행 물량을 전량 받아갔다. 형인우씨는 '알테오젠' 투자 대박으로 유명한 인물이다.유한양행은 2011년 엔솔바이오사이언스 주식 취득 이후 14년 만에 모두 처분하며 127억원의 수익을 냈다. 다만 처분 단가가 1만7500원이어서 의구심을 자아냈다. 이는 전일 종가(2만5500원)보다 30% 가량 낮은 수치였다. 유한양행은 임상 실패에, 형인우씨는 성공에 베팅했다는 해석이 나왔다.이후 엔솔바이오사이언스 주가는 6월 30일 3만6050원까지 치솟았다. 유한양행의 처분단가(1만7500원)보다 2배 이상 올랐다. 불과 20여일 만이다. 이에 유한양행의 손절 타이밍이 빨랐다는 의견이 나왔다.다만 8월 11일 P2K 3상 실패 소식이 전해지며 결과적으로 유한양행의 엔솔바이오사이언스 전량 엑시트는 성공적이었다는 평가를 받게 됐다.잇단 엑시트 '오픈이노베이션 전략유한양행은 엔솔바이오사이언스 외에도 바이오벤처 엑시트에 나서고 있다. 지난해만 봐도 워랜텍, 제넥신, 에이프릴바이오 지분을 전량 처분했다.타법인 지분 매도는 올해도 이어지고 있다.유한양행은 5월 28일부터 6월 20일까지 지아이이노베이션의 주식 총 108만3417주를 매도했다. 총 처분 금액은 204억원이다. 남은 주식 수는 108만3418주, 지분율은 1.7%로 떨어졌다.이번에 매도한 주식은 대부분 시리즈B 물량으로 파악된다. 시리즈B 투자금 60억원을 고려하면 이번 지분매도로 유한양행이 벌어들인 수익은 약 140억원에 달할 것으로 추정된다. 대략 240% 수익률이다.업계 관계자는 "유한양행이 과거 투자한 바이오 기업의 포트폴리오를 정리하는 모습이다. 타법인 투자에 집중하던 오픈이노베이션 전략이 변화하고 있다"고 분석했다.2025-08-08 06:00:39이석준 -
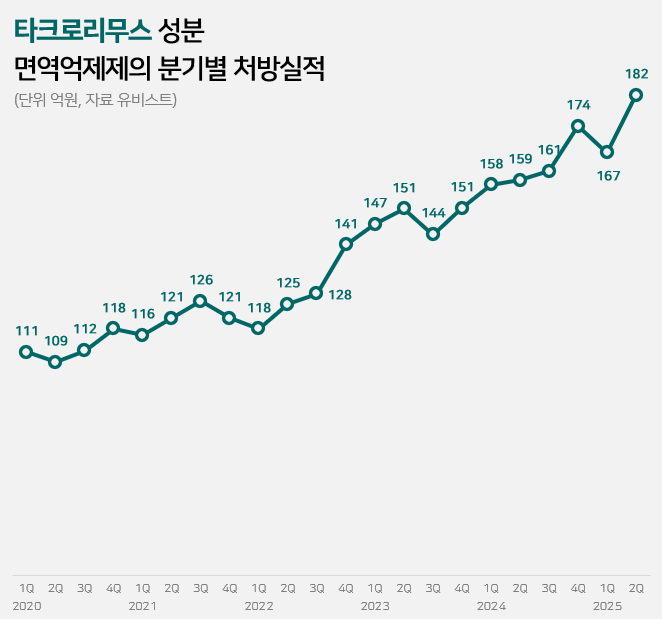 잠잠하던 면역억제제 시장 3년 새 급팽창…종근당 두각[데일리팜=김진구 기자] 타크로리무스·사이클로스포린·미코페놀레이트 등 주요 면역억제제 시장이 최근 3년 새 빠르게 팽창하는 모습이다.관련 시장은 2022년까지 5% 미만으로 비교적 완만하게 성장했으나, 2023년 이후론 매년 10% 이상 확대되는 등 최근 성장세가 가팔라졌다. 타크로리무스와 미코페놀레이트 시장의 경우 올해 상반기에도 이같은 성장세가 이어진 것으로 나타났다.업체별로는 세 성분 모두에서 종근당이 두각을 드러내고 있다. 사이클로스포린과 미코페놀레이트 시장에선 종근당 사이폴엔과 마이렙트가 과반의 점유율을 차지한 상태다. 타크로리무스 시장에선 2위를 차지하며 존재감을 드러내고 있다.잠잠하던 타크로리무스 면역억제제 시장, 2023년 이후 급성장8일 의약품 시장조사기관 유비스트에 따르면 지난 상반기 타크로리무스 성분 면역억제제의 원외처방 실적은 349억원이다. 작년 상반기 317억원 대비 1년 새 10% 증가했다.타크로리무스는 칼시뉴린(Calcineurine) 억제제 계열의 면역억제제다. 간·신장·골수 이식 후 거부반응 억제와 류마티스관절염·루푸스신염 등 자가면역질환의 치료에 주로 쓰인다. 원외처방 시장에선 자가면역질환 치료 목적의 처방실적이 주로 집계된 것으로 분석된다. 이 시장은 2022년까지 완만한 성장세가 이어진 바 있다. 2020년 450억원 규모였던 타크로리무스 면역억제제 시장은 이듬해 484억원으로 7% 늘었다. 이어 2022년엔 512억원으로 6% 증가했다.그러나 2023년 이후 성장세가 가팔라졌다. 2023년엔 593억원의 처방실적으로 전년대비 16% 증가했다. 지난해엔 652억원으로 이보다 10% 더 늘었다. 이어 올해 상반기에도 10%의 증가율을 기록하며 최근의 높은 성장세가 이어지는 모습이다.성장세가 가팔라지기 이전인 2022년 상반기와 비교하면 3년 새 237억원에서 349억원으로 44% 확대된 셈이다.사이클로스포린 시장 3년 새 25%↑…미코페놀레이트는 67% 껑충또 다른 칼시뉴린 억제제 계열 면역억제제인 사이클로스포린도 비슷한 양상이다. 사이클로스포린은 타크로리무스와 적응증이 유사하다. 간·신장·심장·폐·췌장 등 장기이식 후 거부반응 억제 또는 건선·류마티스관절염·재생불량성빈혈·신증후군 등 자가면역질환에 두루 쓰인다. 동일 성분 점안액은 결막염 치료 등에 사용된다. 다만 면억억제제를 대상으로 한 이번 집계에선 제외했다.이 시장 역시 2023년 이후 성장세가 가팔라졌다. 직전까지는 2020년 284억원, 2021년 300억원, 2022년 293억원 등으로 300억원 내외의 처방실적이 유지됐다. 그러나 2023년 318억원으로 전년대비 9% 증가하더니, 지난해엔 358억원으로 이보다 13% 더 확대됐다.올해 상반기의 경우 177억원의 처방실적을 기록했다. 2022년 상반기 142억원과 비교해 3년 새 25% 증가했다. 항대사제(Anti-metabolites) 계열 면역억제제인 미코페놀레이트도 2023년을 전후로 성장세가 가팔라진 것으로 나타났다.미코페놀레이트 시장은 2020년 127억원, 2021년 117억원, 2022년 128억원 등으로 2022년까지 들쭉날쭉한 모습을 보였다. 그러나 2023년 들어 154억원으로 전년대비 20% 증가하더니, 지난해엔 이보다 19% 더욱 늘어난 184억원을 기록했다.올해 상반기엔 101억원의 처방실적을 기록했다. 2022년 상반기 60억원과 비교하면 3년 새 67% 증가했다. 종근당 면역억제제 시장 주도…상반기 3개 제품 합산 처방액 283억원업체별로는 종근당이 세 성분 면역억제제 시장 모두에서 존재감을 드러나고 있다. 종근당 타크로벨·사이폴엔·마이렙트의 올해 상반기 합산 처방실적은 283억원으로 전년동기 대비 5% 증가했다.타크로리무스 시장에선 종근당 타크로벨이 아스텔라스 프로그랍에 이어 2위를 차지했다. 타크로벨의 올 상반기 처방실적은 87억원으로, 작년 상반기 82억원 대비 7% 증가했다. 같은 기간 아스텔라스 프로그랍은 163억원에서 184억원으로 13% 늘었다. 사이클로스포린 시장에선 종근당 사이폴엔이 과반의 점유율로 시장을 주도하는 상황이다. 사이폴엔의 상반기 처방실적은 128억원으로 작년과 비슷한 수준을 유지했다. 시장에서의 점유율은 73% 수준이다. 노바티스 산디문뉴오랄은 상반기 26억원의 처방실적을 기록하는 데 그쳤다.미코페놀레이트 시장에서도 종근당 마이렙트가 점유율 67%로 독주체제를 유지하고 있다. 마이렙트의 상반기 처방액은 68억원으로, 작년 상반기 61억원 대비 12% 증가했다. 같은 기간 로슈의 셀셉트는 16억원에서 19억원으로 15% 늘었고, 노바티스 마이폴틱은 8억원에서 10억원으로 증가했다.2025-08-08 06:00:00김진구
잠잠하던 면역억제제 시장 3년 새 급팽창…종근당 두각[데일리팜=김진구 기자] 타크로리무스·사이클로스포린·미코페놀레이트 등 주요 면역억제제 시장이 최근 3년 새 빠르게 팽창하는 모습이다.관련 시장은 2022년까지 5% 미만으로 비교적 완만하게 성장했으나, 2023년 이후론 매년 10% 이상 확대되는 등 최근 성장세가 가팔라졌다. 타크로리무스와 미코페놀레이트 시장의 경우 올해 상반기에도 이같은 성장세가 이어진 것으로 나타났다.업체별로는 세 성분 모두에서 종근당이 두각을 드러내고 있다. 사이클로스포린과 미코페놀레이트 시장에선 종근당 사이폴엔과 마이렙트가 과반의 점유율을 차지한 상태다. 타크로리무스 시장에선 2위를 차지하며 존재감을 드러내고 있다.잠잠하던 타크로리무스 면역억제제 시장, 2023년 이후 급성장8일 의약품 시장조사기관 유비스트에 따르면 지난 상반기 타크로리무스 성분 면역억제제의 원외처방 실적은 349억원이다. 작년 상반기 317억원 대비 1년 새 10% 증가했다.타크로리무스는 칼시뉴린(Calcineurine) 억제제 계열의 면역억제제다. 간·신장·골수 이식 후 거부반응 억제와 류마티스관절염·루푸스신염 등 자가면역질환의 치료에 주로 쓰인다. 원외처방 시장에선 자가면역질환 치료 목적의 처방실적이 주로 집계된 것으로 분석된다. 이 시장은 2022년까지 완만한 성장세가 이어진 바 있다. 2020년 450억원 규모였던 타크로리무스 면역억제제 시장은 이듬해 484억원으로 7% 늘었다. 이어 2022년엔 512억원으로 6% 증가했다.그러나 2023년 이후 성장세가 가팔라졌다. 2023년엔 593억원의 처방실적으로 전년대비 16% 증가했다. 지난해엔 652억원으로 이보다 10% 더 늘었다. 이어 올해 상반기에도 10%의 증가율을 기록하며 최근의 높은 성장세가 이어지는 모습이다.성장세가 가팔라지기 이전인 2022년 상반기와 비교하면 3년 새 237억원에서 349억원으로 44% 확대된 셈이다.사이클로스포린 시장 3년 새 25%↑…미코페놀레이트는 67% 껑충또 다른 칼시뉴린 억제제 계열 면역억제제인 사이클로스포린도 비슷한 양상이다. 사이클로스포린은 타크로리무스와 적응증이 유사하다. 간·신장·심장·폐·췌장 등 장기이식 후 거부반응 억제 또는 건선·류마티스관절염·재생불량성빈혈·신증후군 등 자가면역질환에 두루 쓰인다. 동일 성분 점안액은 결막염 치료 등에 사용된다. 다만 면억억제제를 대상으로 한 이번 집계에선 제외했다.이 시장 역시 2023년 이후 성장세가 가팔라졌다. 직전까지는 2020년 284억원, 2021년 300억원, 2022년 293억원 등으로 300억원 내외의 처방실적이 유지됐다. 그러나 2023년 318억원으로 전년대비 9% 증가하더니, 지난해엔 358억원으로 이보다 13% 더 확대됐다.올해 상반기의 경우 177억원의 처방실적을 기록했다. 2022년 상반기 142억원과 비교해 3년 새 25% 증가했다. 항대사제(Anti-metabolites) 계열 면역억제제인 미코페놀레이트도 2023년을 전후로 성장세가 가팔라진 것으로 나타났다.미코페놀레이트 시장은 2020년 127억원, 2021년 117억원, 2022년 128억원 등으로 2022년까지 들쭉날쭉한 모습을 보였다. 그러나 2023년 들어 154억원으로 전년대비 20% 증가하더니, 지난해엔 이보다 19% 더욱 늘어난 184억원을 기록했다.올해 상반기엔 101억원의 처방실적을 기록했다. 2022년 상반기 60억원과 비교하면 3년 새 67% 증가했다. 종근당 면역억제제 시장 주도…상반기 3개 제품 합산 처방액 283억원업체별로는 종근당이 세 성분 면역억제제 시장 모두에서 존재감을 드러나고 있다. 종근당 타크로벨·사이폴엔·마이렙트의 올해 상반기 합산 처방실적은 283억원으로 전년동기 대비 5% 증가했다.타크로리무스 시장에선 종근당 타크로벨이 아스텔라스 프로그랍에 이어 2위를 차지했다. 타크로벨의 올 상반기 처방실적은 87억원으로, 작년 상반기 82억원 대비 7% 증가했다. 같은 기간 아스텔라스 프로그랍은 163억원에서 184억원으로 13% 늘었다. 사이클로스포린 시장에선 종근당 사이폴엔이 과반의 점유율로 시장을 주도하는 상황이다. 사이폴엔의 상반기 처방실적은 128억원으로 작년과 비슷한 수준을 유지했다. 시장에서의 점유율은 73% 수준이다. 노바티스 산디문뉴오랄은 상반기 26억원의 처방실적을 기록하는 데 그쳤다.미코페놀레이트 시장에서도 종근당 마이렙트가 점유율 67%로 독주체제를 유지하고 있다. 마이렙트의 상반기 처방액은 68억원으로, 작년 상반기 61억원 대비 12% 증가했다. 같은 기간 로슈의 셀셉트는 16억원에서 19억원으로 15% 늘었고, 노바티스 마이폴틱은 8억원에서 10억원으로 증가했다.2025-08-08 06:00:00김진구 -
 진단·에스테틱 팔고 항암신약 '올인'...LG화학 체질개선 속도[데일리팜=차지현 기자] LG화학이 필러 등 사업을 영위하는 에스테틱 사업부를 국내 사모펀드(PEF) 운용사에 매각한다. 비핵심 사업을 정리하고 고성장·고수익 사업에 집중하기 위한 리밸런싱 전략의 일환이다.LG화학은 이번 매각 이후 항암 파이프라인 강화에 속도를 낸다는 구상이다. 회사는 비핵심 사업부 매각과 기술수출 등을 통해 확보한 자금을 기반으로 초기 임상 단계 유망 항암 과제 도입도 지속 검토 중이다.진단 이어 에스테틱 사업도 매각…국내 PEF 운용사에 2000억 규모 매각LG화학은 생명과학사업본부 내 에스테틱 사업부를 매각한다고 7일 공시했다. 양도가액은 2000억원으로, 지난해 말 자기자본 47조9955억원 대비 0.42% 규모다. 양수법인은 국내 PEF 운용사 VIG파트너스다.LG화학 에스테틱 사업부는 필러와 스킨부스터 등 피부·미용 의료기기를 중심으로 사업을 전개해 왔다. 히알루로산 필러인 '이브아르'와 스킨부스터 '비알팜', '인에이블', '비타란' 등이 대표 제품군이다. 해당 사업부 매출은 약 1000억원 정도로 추산된다.이번 매각은 포트폴리오 리밸런싱 전략의 일환이다. LG화학은 비주력 자산을 정리하고 친환경 소재와 배터리 소재, 혁신신약 등 신성장동력에 역량을 집중하겠다는 청사진 아래 구조조정을 단행해왔다. LG화학은 앞서 2023년 생명과학부문 내 진단사업부를 글랜우드PE에 사업부 분할(카브아웃) 방식으로 매각한 바 있다.LG화학은 에스테틱 사업부 역시 2023년경부터 매각을 타진해온 것으로 알려진다. 백신사업부와 함께 묶어 일괄 매각하는 방안까지 검토됐지만, 복수 원매자와 협의에도 불구하고 가격 등 조건에서 이견을 좁히지 못하고 협상이 좌초됐다. 오송 공장을 백신사업부와 공유하는 구조 탓에 분리 매각에 난항을 겪은 것으로 전해진다.LG화학이 올 초 HSBC증권을 매각 주관사로 선정하하면서 매각 작업이 다시 탄력을 받았다. 당초 LG화학의 희망 매각가는 3000억원대였으나, 최종 거래가는 이보다 낮은 수준에서 조율됐다. 이번에 에스테틱 사업부를 인수한 VIG파트너스는 최근 고주파 미용의료기기업체 비올을 인수하는 등 미용 의료 분야 포트폴리오를 확장 중이다.차동석 LG화학 최고재무책임자(CFO·사장)는 이날 온라인 컨퍼런스콜에서 "생명과학사업본부는 의약품 중의 국내 및 아시아 사업 강화와 글로벌 항암 신약 개발에 핵심 역량을 집중하기 위해 에스테틱 사업 매각을 결정하고 추진했다"면서 "2023년 진단 사업에 이어 금번 에스테틱 사업의 경우에도 시장의 좋은 밸류에이션을 바탕으로 매각을 결정했다"고 했다.항암 중심 포트폴리오 재편…"기술료 유입 기대, 물질 도입 검토 중"LG화학은 이번 매각 이후 항암 파이프라인 강화에 속도를 낸다는 구상이다. 현재 LG화학의 항암제 개발은 재작년 인수한 미국 아베오파마슈티컬스를 중심으로 이뤄지고 있다. LG화학은 지난 2023년 아베오 지분 100% 인수에 5억7100만 달러를 투입한 바 있다. 아베오는 미국 보스턴 소재 항암제 전문 개발사로 미국 식품의약국(FDA) 품목허가를 받은 신장암 3차 치료제 '포티브다'를 보유했다.항암제로 선택과 집중을 선언한 LG화학은 신약 포트폴리오 역시 항암제 중심으로 조정 중이다. LG화학은 지난해 희귀 비만증 치료제 후보물질 'LB54640 '을 미국 나스닥 상장사 리듬파마슈티컬스에 선급금 1억 달러(약 1300억원)를 포함한 총 3억500만달러(약 4000억원) 규모로 기술이전했다. 높은 선급금을 받고 해당 자산을 정리함으로써 항암 중심 전략에 속도를 내겠다는 의도다.이어 LG화학은 올 초 통풍 치료제 후보물질 '티굴릭소스타트' 다국가 임상 3상(EURELIA2)도 자진 중단했다. 이와 관련 LG화학은 "전년도 EURELIA1 임상에서 안전성과 위약 대비 유의미한 개선 효과를 확인했지만, EURELIA2는 상업화 가능성과 전략적 자원 재배분을 고려해 중단했다"고 설명했다.LG화학 파이프라인 개발 현황(자료: LG화학) 현재 항얌 분야에서 LG화학이 주력하는 분야는 두경부암, 면역항암제, 암 악액질 치료제 등이다. 회사는 사업부 매각과 기술수출 등을 통해 확보한 자금을 기반으로 항암제 개발에 힘을 쏟는 한편 초기 임상 단계 유망 항암 과제 도입도 지속 검토 중이라는 입장을 내놨다.LG화학 생명과학 부문은 4분기만에 흑자 전환에 성공했다. 올해 2분기 연결기준 LG화학 생명과학 부문 영업이익은 250억원으로 전년동기 130억원 영업손실에서 흑자로 돌아섰다. 매출은 전년동기 대비 17.8% 증가한 3370억원을 기록했다. LG화학 생명과학 부문은 작년 3분기부터 올해 1분기까지 3분기 연속 적자를 기록한 바 있다.차 CFO는 "작년 기술수출한 희귀 비만 치료제의 경우 최근 파트너사가 임상 2상에서 긍정적 결과를 발표하면서 안정적인 마일스톤과 로열티 수치에 대한 기대감이 커졌다"면서 "생명과학사업본부는 항암 사업 강화를 위해 유망 항암 물질 중심으로 초기 임상 과제 도입 인수를 지속 검토 중이나 추가 인수합병(M&A)은 아직 확정된 바가 없다"고 했다.이어 그는 "앞으로도 항암 영역으로 역량과 리소스를 보다 강화하기 위해 포트폴리오 리밸런싱을 지속해 나갈 것"이라며 "비만 치료제 기술수출 사례와 같이 전략적인 외부 협업을 통해 R&D 자원을 효율적으로 운영, 글로벌 제약사로 도약하겠다"고 덧붙였다.2025-08-08 06:00:00차지현
진단·에스테틱 팔고 항암신약 '올인'...LG화학 체질개선 속도[데일리팜=차지현 기자] LG화학이 필러 등 사업을 영위하는 에스테틱 사업부를 국내 사모펀드(PEF) 운용사에 매각한다. 비핵심 사업을 정리하고 고성장·고수익 사업에 집중하기 위한 리밸런싱 전략의 일환이다.LG화학은 이번 매각 이후 항암 파이프라인 강화에 속도를 낸다는 구상이다. 회사는 비핵심 사업부 매각과 기술수출 등을 통해 확보한 자금을 기반으로 초기 임상 단계 유망 항암 과제 도입도 지속 검토 중이다.진단 이어 에스테틱 사업도 매각…국내 PEF 운용사에 2000억 규모 매각LG화학은 생명과학사업본부 내 에스테틱 사업부를 매각한다고 7일 공시했다. 양도가액은 2000억원으로, 지난해 말 자기자본 47조9955억원 대비 0.42% 규모다. 양수법인은 국내 PEF 운용사 VIG파트너스다.LG화학 에스테틱 사업부는 필러와 스킨부스터 등 피부·미용 의료기기를 중심으로 사업을 전개해 왔다. 히알루로산 필러인 '이브아르'와 스킨부스터 '비알팜', '인에이블', '비타란' 등이 대표 제품군이다. 해당 사업부 매출은 약 1000억원 정도로 추산된다.이번 매각은 포트폴리오 리밸런싱 전략의 일환이다. LG화학은 비주력 자산을 정리하고 친환경 소재와 배터리 소재, 혁신신약 등 신성장동력에 역량을 집중하겠다는 청사진 아래 구조조정을 단행해왔다. LG화학은 앞서 2023년 생명과학부문 내 진단사업부를 글랜우드PE에 사업부 분할(카브아웃) 방식으로 매각한 바 있다.LG화학은 에스테틱 사업부 역시 2023년경부터 매각을 타진해온 것으로 알려진다. 백신사업부와 함께 묶어 일괄 매각하는 방안까지 검토됐지만, 복수 원매자와 협의에도 불구하고 가격 등 조건에서 이견을 좁히지 못하고 협상이 좌초됐다. 오송 공장을 백신사업부와 공유하는 구조 탓에 분리 매각에 난항을 겪은 것으로 전해진다.LG화학이 올 초 HSBC증권을 매각 주관사로 선정하하면서 매각 작업이 다시 탄력을 받았다. 당초 LG화학의 희망 매각가는 3000억원대였으나, 최종 거래가는 이보다 낮은 수준에서 조율됐다. 이번에 에스테틱 사업부를 인수한 VIG파트너스는 최근 고주파 미용의료기기업체 비올을 인수하는 등 미용 의료 분야 포트폴리오를 확장 중이다.차동석 LG화학 최고재무책임자(CFO·사장)는 이날 온라인 컨퍼런스콜에서 "생명과학사업본부는 의약품 중의 국내 및 아시아 사업 강화와 글로벌 항암 신약 개발에 핵심 역량을 집중하기 위해 에스테틱 사업 매각을 결정하고 추진했다"면서 "2023년 진단 사업에 이어 금번 에스테틱 사업의 경우에도 시장의 좋은 밸류에이션을 바탕으로 매각을 결정했다"고 했다.항암 중심 포트폴리오 재편…"기술료 유입 기대, 물질 도입 검토 중"LG화학은 이번 매각 이후 항암 파이프라인 강화에 속도를 낸다는 구상이다. 현재 LG화학의 항암제 개발은 재작년 인수한 미국 아베오파마슈티컬스를 중심으로 이뤄지고 있다. LG화학은 지난 2023년 아베오 지분 100% 인수에 5억7100만 달러를 투입한 바 있다. 아베오는 미국 보스턴 소재 항암제 전문 개발사로 미국 식품의약국(FDA) 품목허가를 받은 신장암 3차 치료제 '포티브다'를 보유했다.항암제로 선택과 집중을 선언한 LG화학은 신약 포트폴리오 역시 항암제 중심으로 조정 중이다. LG화학은 지난해 희귀 비만증 치료제 후보물질 'LB54640 '을 미국 나스닥 상장사 리듬파마슈티컬스에 선급금 1억 달러(약 1300억원)를 포함한 총 3억500만달러(약 4000억원) 규모로 기술이전했다. 높은 선급금을 받고 해당 자산을 정리함으로써 항암 중심 전략에 속도를 내겠다는 의도다.이어 LG화학은 올 초 통풍 치료제 후보물질 '티굴릭소스타트' 다국가 임상 3상(EURELIA2)도 자진 중단했다. 이와 관련 LG화학은 "전년도 EURELIA1 임상에서 안전성과 위약 대비 유의미한 개선 효과를 확인했지만, EURELIA2는 상업화 가능성과 전략적 자원 재배분을 고려해 중단했다"고 설명했다.LG화학 파이프라인 개발 현황(자료: LG화학) 현재 항얌 분야에서 LG화학이 주력하는 분야는 두경부암, 면역항암제, 암 악액질 치료제 등이다. 회사는 사업부 매각과 기술수출 등을 통해 확보한 자금을 기반으로 항암제 개발에 힘을 쏟는 한편 초기 임상 단계 유망 항암 과제 도입도 지속 검토 중이라는 입장을 내놨다.LG화학 생명과학 부문은 4분기만에 흑자 전환에 성공했다. 올해 2분기 연결기준 LG화학 생명과학 부문 영업이익은 250억원으로 전년동기 130억원 영업손실에서 흑자로 돌아섰다. 매출은 전년동기 대비 17.8% 증가한 3370억원을 기록했다. LG화학 생명과학 부문은 작년 3분기부터 올해 1분기까지 3분기 연속 적자를 기록한 바 있다.차 CFO는 "작년 기술수출한 희귀 비만 치료제의 경우 최근 파트너사가 임상 2상에서 긍정적 결과를 발표하면서 안정적인 마일스톤과 로열티 수치에 대한 기대감이 커졌다"면서 "생명과학사업본부는 항암 사업 강화를 위해 유망 항암 물질 중심으로 초기 임상 과제 도입 인수를 지속 검토 중이나 추가 인수합병(M&A)은 아직 확정된 바가 없다"고 했다.이어 그는 "앞으로도 항암 영역으로 역량과 리소스를 보다 강화하기 위해 포트폴리오 리밸런싱을 지속해 나갈 것"이라며 "비만 치료제 기술수출 사례와 같이 전략적인 외부 협업을 통해 R&D 자원을 효율적으로 운영, 글로벌 제약사로 도약하겠다"고 덧붙였다.2025-08-08 06:00:00차지현
오늘의 TOP 10
- 1콜린알포 점유율 회복 '꿈틀'...급여축소 부담 희석되나
- 2"어린이 해열제, 복약지도 이것만은 꼭"
- 3대형마트 내 창고형약국, 유통발전법으로 제어 가능할까
- 4집으로 찾아가는 동네약사 서비스 도입...약사 91명 투입
- 5'또 창고형' 광주 2곳 개설 움직임…대형마트에도 입점
- 6약사채용 1위 팜리쿠르트, 약국대상 무료공고 오픈
- 7시총 1조 안착했지만…리브스메드, 혹독한 코스닥 데뷔전
- 8[기자의 눈] 플랫폼 도매금지법, 복지부 압박 말아야
- 9눈=루테인? 현대인의 안정피로에는 아스타잔틴
- 10환자 6% 줄었는데 진료건수 60% 증가...소청과의 역설
















